作者:曹君
患者,男,65岁,农民。主诉:发热、胸闷10天,气促4天,抽搐1天。2020年6月11日入院。
2020年6月1日无明显诱因出现发热,无明显昼夜规律,最高体温达40℃,伴胸闷,无胸痛、咳嗽、咯血、盗汗等,当地医院诊治后(具体用药不详),仍反复发热,胸闷较前加重。
2020年6月7日至永州某市级医院,诊断为“发热查因:出血热?肺部感染?钩体病?”先后予以“头孢他啶+左氧氟沙星”“亚胺培南”“头孢吡肟+利巴韦林”治疗后仍发热,气促加重,伴腹痛、腹胀不适,烦躁不安。
2020年6月10日突发抽搐。至我院急诊,经“美罗培南”抗感染,去甲肾上腺素抗休克等治疗后患者仍有发热、胸闷,伴持续性腹痛、腹胀不适,无恶心、呕吐。
2020年6月11日收住我科,患者自发病来,精神、食欲及睡眠较差,大便可,体重无明显变化。
2012年因“预激综合征”于外院行“射频消融术”,恢复可。2015年曾行阑尾切除术。2015年诊断“慢性乙型病毒性肝炎”,未治疗。
否认结核、伤寒、疟疾、高血压、糖尿病病史,无外伤及输血史,否认食物、药物过敏史。无新冠肺炎流行病学史,近期无境外旅居史。
生于湖南省永州市,久居本地,否认血吸虫疫水接触史,吸烟30年,平均10支/天。未戒烟,饮酒30年,平均3两/天,未戒酒,否认毒物接触史。婚育史及家族史无特殊。
T 38.6℃,P 106次/分,R 45次/分,BP 115/67 mmHg。SpO2 90%,经鼻高流量氧疗(FiO2 85%)。躁动不安,面色潮红,头颅五官无畸形,颈无抵抗。双侧瞳孔等圆等大,对光反射存在。皮肤黏膜无黄染,无皮疹,全身浅表淋巴结未触及肿大。无龋齿。心界不大,心率106次/分,律齐,未闻及杂音。呼吸节律两侧对称,呼吸急促,触诊语颤正常,双肺叩诊呈清音,听诊双肺呼吸音粗,双下肺可闻及湿啰音。腹软,未及包块,轻压痛,无反跳痛,移动性浊音阴性,肠鸣音存。肝脾肋下未及,肝区无叩击痛。脊柱、四肢无畸形,各椎体无压痛。双肾区无叩击痛,无输尿管行程压痛。生理反射存在,病理反射未引出。未见杵状指(趾),双下肢无水肿。
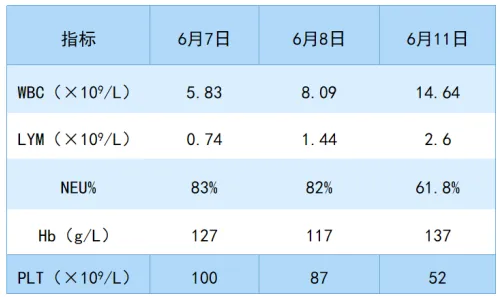
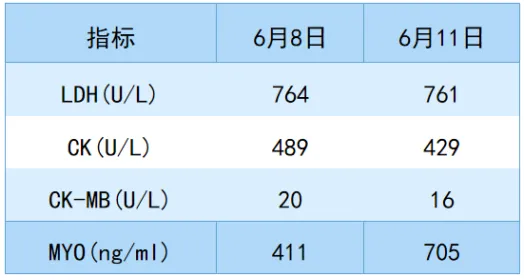
血常规:患者血常规检查结果如表1所示,WBC升高,PLT进行性下降。
尿常规(2020-06-08):隐血试验(++),尿胆红素(+),尿蛋白(+++)。尿比重1.030,pH 5.0,镜检红细胞(++)。
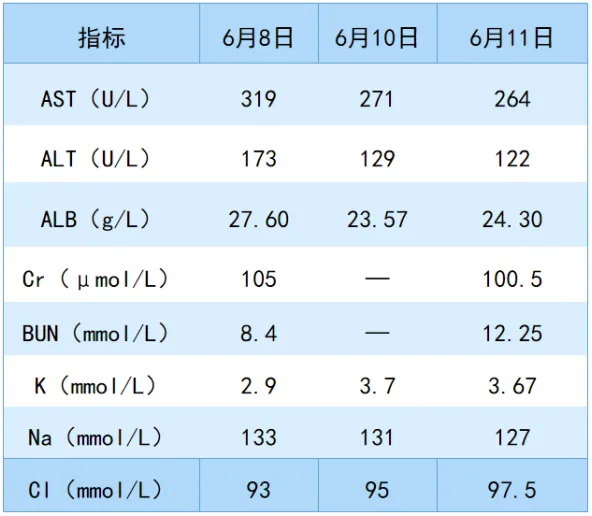
肝肾功能:如表4所示。起病初期,转氨酶和肌酐均明显升高,且有严重的电解质紊乱。
血脂:甘油三酯2.80 mmol/L;血清淀粉酶正常。
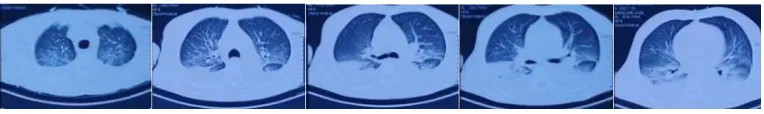
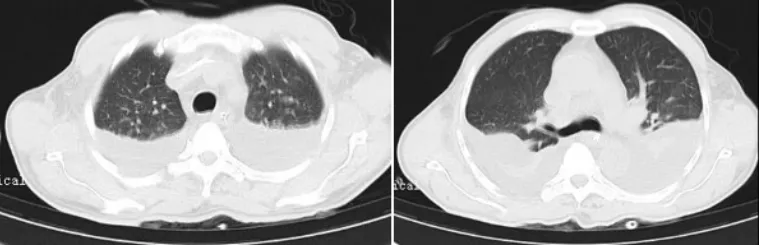
肺炎衣原体抗体(IgG+IgM)、结核杆菌抗体、肥达试验均阴性。影像学:2020年6月7日外院胸部CT示右下肺、左舌叶及左下肺感染可能,双侧少量胸腔积液(图1)。6月9日外院复查胸部CT,病灶较前范围增大,双侧胸腔积液较前增多(图2)。6月11日入我院后胸部CT示双肺炎症,合并肺水肿可能,双侧胸腔积液,双下肺部分萎陷(图3)。
头部CT(6月10日,外院):①双侧基底节-放射冠区腔隙性脑梗死可能,建议MRI检查;②皮层下动脉硬化性脑病;③脑萎缩;④枕大池区改变,性质待定,考虑:大枕大池?蛛网膜囊肿?其他?腹部彩超+泌尿系彩超(6月8日,外院):轻度脂肪肝,脾大,右肾肿,脾周及肝肾间隙、胆囊窝少量积液,建议结合临床进一步检查前列腺增生并钙化灶形成。全腹CT(6月9日,外院):①肝、胆、胰、脾平扫未见明显异常;②右下回盲部改变,考虑:粪石?炎性改变,建议必要时复查;③前列腺增生。全腹部增强CT(6月11日,外院):胰腺炎待排;肝脏多发小囊肿,右肾小囊肿,膀胱炎;前列腺增大,少量腹水。①重症肺炎,Ⅰ型呼吸衰竭,急性呼吸窘迫综合征;②脓毒症,脓毒性休克;③多脏器功能损害(肝、肾、血液);④双侧胸腔积液:感染性?非感染性?⑤低蛋白血症;⑥电解质紊乱(低钠、低氯血症);⑦高甘油三酯血症;⑧乙型慢性病毒性肝炎;⑨胰腺炎?⑩腔隙性脑梗死。
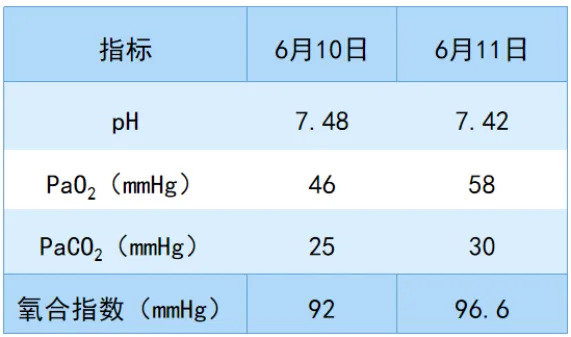
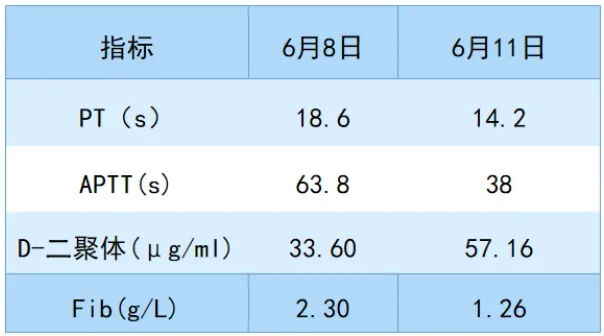
6月7日:高热、胸闷、气促、腹痛、腹泻;贫血、PLT下降;PT、APTT升高;肝损伤、低蛋白血症;肾损伤、尿蛋白;肌酶升高;低钠、低钾、低氯;脾大;双肺渗出。6月10日:抽搐,休克。双肺渗出增多,双侧胸腔积液,胰腺炎?腹水,氧合指数<100 mmHg。6月11日:骨髓组织可见吞噬细胞,考虑噬血细胞综合征?血常规(6月12日):NEU 6.7×109/L,Hb 107 g/L,PLT 61×109/L。淋巴结B超:最大15 mm×9 mm,边界清晰,形态可。
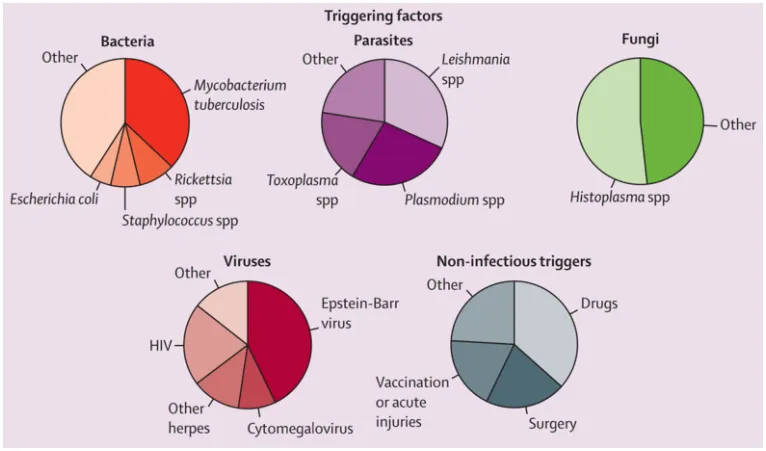
2014年Lancet杂志发表文章提出了成人噬血细胞综合征的诊断意见,符合以下8条指标中的5条即可诊断为继发性噬血细胞综合征:①发热:体温>38.5℃,持续大于7天;②脾大;③血细胞减少(累及外周血两系或三系):血红蛋白<90 g/L,血小板<100×109/L,中性粒细胞<1.0×109/L且非骨髓造血功能减低所致;④高甘油三酯血症和/或低纤维蛋白原血症:甘油三酯>3 mmol/L、纤维蛋白原<1.5 g/L或低于同年龄的3个标准差;⑤在骨髓、脾、肝或淋巴结内找到血细胞;⑥血清铁蛋白升高:铁蛋白≥500 μg/L;⑦NK细胞活性降低或缺如;⑧可溶性白细胞介素-2受体(sCD25)升高。噬血细胞综合征是一组由原发或继发性免疫异常所致的过度炎症反应综合征,淋巴细胞、单核细胞和巨噬细胞系统异常激活、增殖,分泌大量炎性细胞因子,引起一系列炎症反应。导致噬血细胞综合征的原因就有原发性和继发性。原发性噬血细胞综合征是一种常染色体或性染色体隐性遗传病,多发于幼年,由于基因缺陷引起。目前已知的明确与噬血细胞综合征相关的基因有12种。继发性原因包括感染、肿瘤、风湿免疫、药物。
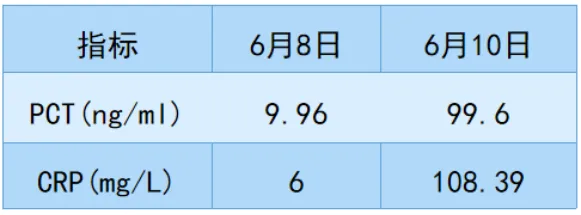
本例患者:发热10天,脾大,PLT 52×109/L,Hb 107 g/L,FIB 1.26 g/L,甘油三酯2.8 mmol/L,骨髓可见嗜血细胞,铁蛋白1695 ng/ml。根据上述诊断标准,考虑患者为噬血细胞综合征。导致本例患者发病的原因究竟是什么?感染继发?还是非感染因素引起?非感染性因素相关检查:①肿瘤:CA125 67.85 U/ml,细胞角蛋白19片段4.21 ng/ml,T-PSA 6.69 ng/ml,TPSA 4.261 ng/ml。②BNP(6月12日):1499 pg/ml。③自身免疫:免疫+狼疮全套、RF、ANCA、自免肝全套未见异常。④骨髓穿刺:无血液系统恶性疾病依据。⑤淋巴瘤:LDH升高,淋巴结B超示淋巴结稍大。上述结果不能完全解释噬血细胞综合征。感染性因素相关检查:患者自起病以来主要临床表现为发热,1周后出现肺部病灶,多次查PCT和CRP均较高,因此,感染引起的噬血细胞综合征的可能性大,感染部位考虑为肺和血液,社区获得性感染。 在抗菌药物选择方面,我们主要关注5个问题:①有无感染?②病原体是什么——细菌、真菌、病毒?③药物能否到达感染部位?④药物能否覆盖病原体?⑤药物安全性及经济学。
本例患者的宿主因素有:乙型肝炎病史,肝肾功能不全,血小板减少,消化道、神经系统症状。微生物方面为社区获得性感染。初始方案:哌拉西林他唑巴坦覆盖革兰阳性菌和革兰阴性菌。替加环素覆盖非典型病原体,肝肾功能不全无需调整剂量,肺组织浓度高,社区获得性肺炎也是该药的适应证。除了抗感染治疗,还要积极寻找病原体。
(1)病毒:①血:TORCH:CMV-lgG 45.2 U/ml,CMV-IgM 22.9 U/ml,HSV 1+2型lgG 4.29 Index,HSV 1+2型IgM>3.5 Index。汉坦病毒IgM阳性,IgG阴性;输血前阴性;EBV-DNA、CMV-DNA阴性;腺病毒/呼吸道合胞病毒/流感lgM均阴性。②咽拭子:呼吸道病毒抗原七项DNA均阴性。③BALF:CMV DNA、EB病毒DNA、腺病毒DNA均阴性。
(2)细菌:①血:多次血培养阴性,血涂片疟原虫阴性。CP-lgG可疑阳性,MP-IgG阴性。呼九联(军团菌/MP/CP/Q热立克次体IgM)、肥达外斐试验(外斐试验仅OX19)。②BALF:抗酸染色阴性,X-pert阴性。细菌涂片镜检偶见革兰阴性杆菌;细菌培养阴性。MP-DNA阴性,呼吸道病原体核酸检测鲍曼不动杆菌阳性。
(3)真菌:①血:GM试验0.65 μg/L,G试验阴性,隐球菌荚膜抗原阴性。②BALF:真菌涂片及培养均阴性;GM试验阴性;真菌免疫荧光阴性。
流行性出血热的感染源为黑线姬鼠,主要表现为发热、休克、充血、出血、急性肾衰竭,“三红、三痛”。基本病变为小血管内皮细胞肿胀、变性、坏死,全身小血管和肾脏病变最明显,其次为心、肝、脑。流行季节为冬春季(11月至次年1月为发病高峰、5月至7月为小高峰);病程分期为:发热期—低血压休克期—少尿期—多尿期—恢复期。
本例患者:①发病时间:6月。②传染源:农村、家中不排除有鼠类出没、起病前曾参加葬礼葬(土葬)。③传播途径:不排除接触鼠类体液污染物品或食物。④临床特点:发热、尿蛋白,无多尿、少尿、眼结膜下出血、腓肠肌痛,发病5期过程不典型。⑤汉坦病毒抗体检测假阳性:其他感染、自身免疫疾病、肿瘤、注射丙种球蛋白等可出现假阳性。因此,流行性出血热诊断存疑。 TORCH:CMV-IgG、CMV-IgM、HSV1+2型-IgG、HSV1+2型-IgM均升高。CMV-DNA阴性,高危因素、胸部影像学等不甚支持。因此,CMV、HSV感染依据不足。
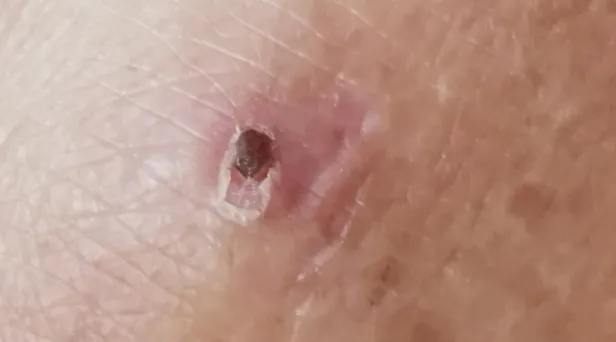
(1)根据关键词“发热+多脏器损害+噬血细胞综合征”查阅文献发现:①在细菌/结核中,普通细菌较少,伤寒可以出现此类症状,结核也可以,但结核主要为发热+噬血细胞综合征,多脏器损害比较少见。②支原体、衣原体、军团菌中,鹦鹉热、嗜肺军团菌可以导致上述症状。③立克次体中恙虫病可出现。④螺旋体中钩端螺旋体病可出现。⑤病毒中的流行性出血热、流脑、登革热可有上述表现。⑥真菌:本例患者GM试验稍高,但G试验、隐球菌荚膜抗原阴性,本例诊断依据不足。⑦寄生虫:无嗜酸性粒细胞升高,本例支持依据不足。(2)根据关键词“感染相关噬血细胞综合征”查阅文献。国外一项荟萃分析显示在2197例已报道的成人噬血细胞综合征的主要诱因中,50.4%为感染。感染的细菌最常见的是结核分枝杆菌,然后依次为立克次体、金黄色葡萄球菌、肠杆菌,感染的寄生虫中最常见的是利什曼原虫、疟原虫以及弓形虫。感染的真菌主要是组织胞浆菌。感染的病毒中最常见的是EB病毒,其他如HIV等。因此,本例患者我们重点排查细菌和寄生虫。图源:Lancet, 2014, 383(9927):1503-1516.此时再次排查临床线索:仔细询问患者病史,起病前无下田、不洁水接触;无蚊虫叮咬史;无明确鼠类接触史;未生吃虾蟹等肉类。起病前2周曾参加葬礼(土葬)。脚踝处发现焦痂样皮疹(图4)。
图4 患者脚踝处焦痂样皮疹
患者入院即采血送检mNGS,后回报恙虫病东方体(序列数15529)。BALF mNGS也检出恙虫病东方体序列(序列数1)。至此,患者诊断明确:重症恙虫病;多脏器功能不全(肺、心、肾、肝、血液、脑、胰腺);脓毒症,脓毒性休克;继发性噬血细胞综合征;继发性胰腺炎;消化道出血。患者入院后即予哌拉西林他唑巴坦+替加环素治疗(6月11-13日),当晚患者体温降至正常。6月14日NGS结果回示恙虫病东方体,根据药物经济学及肝损伤考虑与恙虫病相关,将抗感染方案调整为哌拉西林他唑巴坦+多西环素(6月14-25日)。后患者体温趋于正常,且未再发热。
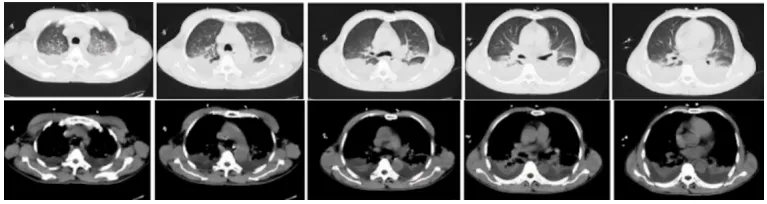
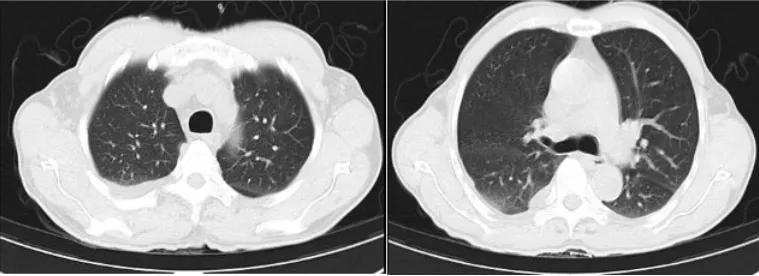
抗炎:甲泼尼龙40 mg使用3天(6月11-13日)。补充血浆、冷沉淀、人纤维蛋白原(6月11-19日)。护胃、护肾、护肝及对症支持处理(6月11-25日)。经鼻高流量氧疗(6月11-17日),鼻导管吸氧(6月18-25日)。患者氧合指数、WBC、Hb、FIB、AST、ALT、ALB、Cr、BUN、BNP、CK、MYO、LDH、电解质、PCT、CRP、铁蛋白等指标随着药物治疗均逐渐恢复正常。6月15日复查影像学,双侧仍有胸腔积液,但双肺渗出较前明显减少(图5)。6月23日胸部CT可见双侧胸腔积液和双肺病变基本吸收(图6)。
患者2020年6月25日出院,2020年8月25日随访恢复可。2020年9月25日电话随访可进行体力劳动。恙虫病,又称丛林斑疹伤寒,是由恙虫病东方体引起的感染。传染源为啮齿动物、鸟类。传播媒介为亚洲和澳大利亚乡村地区的恙螨,恙虫病东方体的原始贮存宿主。频繁接触草地,野外劳动者是该病的易感人群。恙螨/恙虫病东方体入血引起立克次体血症,导致机体出现全身小血管炎、血管周围炎、单核吞噬细胞增生。进而导致全身中毒症状、皮疹、淋巴结肿大、肝脾大以及重要脏器受损,如心肌炎、肾损害、脑膜脑炎、肺炎、出血等。如果恙螨/恙虫病东方体入侵局部可以繁殖,引起焦痂、溃疡。恙虫病病程:第1周,发热,全身中毒症状;第2周,多脏器损害表现,神经系统症状,心肌炎,肺炎,广泛出血;第3周,部分患者恢复(病情平稳);第3~4周,部分患者死亡。恙虫病流行季节在5~12月,南区呈大单峰分布(6~9月)。年龄特征:主要集中在41~、51~和61~岁人群。职业特征:农民。空间特征:有空间高聚集性,南区则主要分布在广东、福建、广西东部等地区。恙螨幼虫的身长仅有0.15~0.3 mm,无痛皮疹。引起恙螨叮咬大多需要相对空气湿度至少为80%,通常生活高度距离地面不到20~30 cm的植被中。患者踝关节外露。恙虫病的诊断通常需要结合流行病学史、临床表现、实验室检查(OXA≥1:160,PCR,mNGS)等。治疗药物主要为四环素、大环内酯类及氯霉素。重症恙虫病患者感染可累及各大系统,并发症包括肺炎、急性呼吸窘迫综合征(ARDS)、心肌炎、脑炎、肝炎、弥散性血管内凝血(DIC)、血细胞综合征、急性肾损伤、急性胰腺炎、短暂性肾上腺功能不全、亚急性痛性甲状腺炎及急腹症。当患者符合以下1项即可诊断为重症恙虫病:①中枢神经系统:意识改变、抽搐、脑出血或脑梗死;②呼吸系统:胸部X线片或CT显示双肺浸润,并具有下列至少1项:氧合指数≤250 mmHg,呼吸频率≥30次/min,或需要机械通气;③心脏:心肌炎、心肌缺血或新发的心律失常;④肾脏:血肌酐≥177 μmol/L;⑤感染性休克:收缩压<90 mmHg,或较基础值下降>40 mmHg,且除外其他原因;⑥消化道出血(无消化性溃疡基础);⑦死亡。重症恙虫病以抗生素治疗为首选,如多西环素静脉输注。其次是支持治疗。国外一项研究显示入住ICU并且多器官衰竭的重症恙虫病患者,医院病死率为24.1%,Logistic回归分析显示患者发热持续时间与病死率相关。噬血细胞综合征是恙虫病少见并发症。Naoi等系统分析显示恙虫病并发噬血细胞综合征主要症状包括高热和淋巴造血器官肿大,如淋巴结病和肝脾大。其他器官受累主要见于肺和中枢神经系统。研究发现,在17例成人患者中,ARDS(23.4%)、胸腔积液(5.9%),使用有创机械通气(29.4%);神经系统表现不均一,包括癫痫发作(5.9%)、意识障碍(5.9%)、颅内出血(5.9%)。2014年噬血细胞综合征国际指南及《中国噬血细胞综合征诊断与治疗指南2022年版(2022年版)》均未提及恙虫病相关噬血细胞综合征治疗方案,仅对EB病毒及利什曼原虫相关提出了推荐方案。有文献提示恙虫病相关的噬血细胞综合征可使用单一抗生素治疗,约50%的病例得到显著改善。2022年组织细胞学会和重症医学学会联合发布了ICU中感染相关噬血细胞综合征患者的诊疗指南,按病情轻重分为轻、中、重度。轻度(仅有凝血/外周血象异常),可仅给予病因相关治疗;中度:病因治疗+强烈建议激素治疗;重度:病因+激素+酌情依托泊苷单独或联合其他免疫调节剂治疗。恙虫病相关的噬血细胞综合征与其他继发性病因相关的噬血细胞综合征患者的临床预后相对较好;与肺结核相关的噬血细胞综合征患者的死亡率约为50%,继发于其他疾病的成人噬血细胞综合征患者的死亡率为52.1%。
本例患者为重症恙虫病相关噬血细胞综合征,静脉使用四环素类抗生素及小剂量甲泼尼龙,病情迅速好转,与文献报道一致。
[1] Ramos-Casals M, Brito-Zerón P, López-Guillermo A, et al. Adult haemophagocytic syndrome[J]. Lancet, 2014, 383(9927):1503-1516.
[2] 中国医师协会血液科医师分会, 中华医学会儿科学分会血液学组, 噬血细胞综合征中国专家联盟. 中国噬血细胞综合征诊断与治疗指南(2022年版)[J]. 中华医学杂志, 2022, 102(20):1492-1499.
[3] 岳玉娟, 王玉姣, 李贵昌, 等. 2006—2018年中国大陆恙虫病高发区流行病学特征分析[J]. 疾病监测, 2020, 35(4):301-306.
[4] 戴威, 王瑞丽, 戴元荣, 等. 重症恙虫病诊治进展[J]. 中华医学杂志, 2017, 97(28):2237-2240.
[5] Griffith M, Peter JV, Karthik G, et al. Profile of organ dysfunction and predictors of mortality in severe scrub typhus infection requiring intensive care admission[J]. Indian J Crit Care Med, 2014, 18(8):497-502.
[6] Naoi T, Morita M, Kawakami T, et al. Hemophagocytic Lymphohistiocytosis Associated with Scrub Typhus: Systematic Review and Comparison between Pediatric and Adult Cases[J]. Trop Med Infect Dis, 2018, 3(1):19.

- 湖南省健康管理学会呼吸重症管理专业委员会副主任委员

 后可发表评论
后可发表评论




 公众号
公众号
 客服微信
客服微信