登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:李双凤
单位:郑州大学附属郑州中心医院RICU
脓毒症凝血病是一种血栓性凝血病,其发生机制主要有三条途径:第一条途径,促炎因子诱导内皮细胞及单核细胞组织因子表达进而诱发凝血途径,使凝血酶生成增多,纤维蛋白网络形成。第二条途径,直接激活纤维蛋白溶解酶抑制剂,使过量的凝血酶产生和/或使缺陷的纤维蛋白降解。第三条途径,失调的免疫血栓过度激活凝血,引起DIC并导致主要组织损伤。
2020年发表的一项研究发现,脓毒性休克生存组和死亡组,健康者和脓毒性休克者之间异质性流动指数(HI)存在显著差异,脓毒性休克死亡组HI高于生存组,脓毒性休克组HI高于健康组。2021年发表的一项诊断为休克患者中监测微循环早期变化研究显示,PPV随着治疗进展而出现明显改善。笔者团队开展的研究监测ΔPPV及多配体蛋白聚糖-1(SDC-1)在脓毒性休克合并ARDS患者中的水平,研究发现:死亡组第6、24、72小时的ΔPPV均低于生存组;ΔPPV和SDC-1对脓毒性休克合并ARDS患者28天预后有预测价值。此外,第72小时的ΔPPV联合SDC-1的曲线下面积最大,提示在本研究动态监测的几个时间点第72小时的指标联合对预后的预测价值更大。另外, 笔者团队另一项关于乳酸清除率联合SDC-1对脓毒性休克并ARDS预后的预测价值研究发现, 24小时血乳酸清除率(LCR)、24小时SDC-1、72小时SDC-1、24小时LCR联合24小时SDC-1均对脓毒性休克并ARDS患者的28天预后有预测价值, 且24小时LCR联合24小时SDC-1具有最大的曲线下面积。
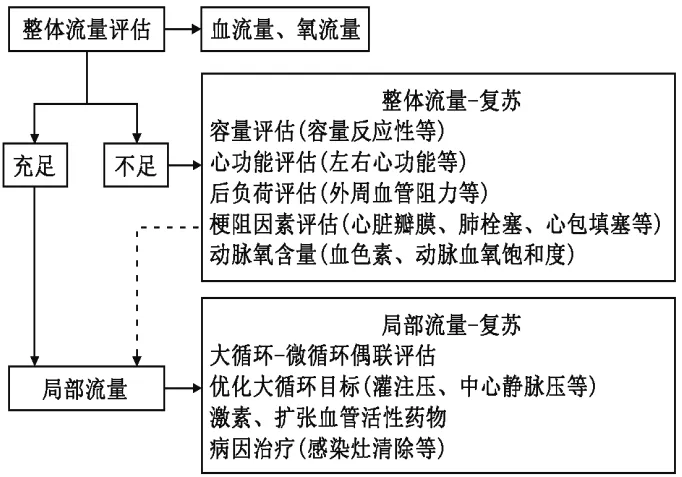
图1 整体流量评估流程
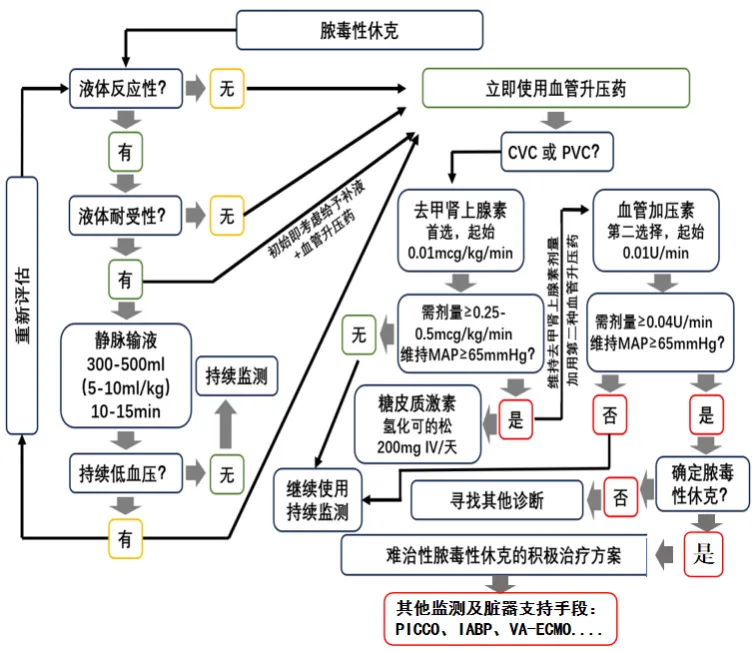
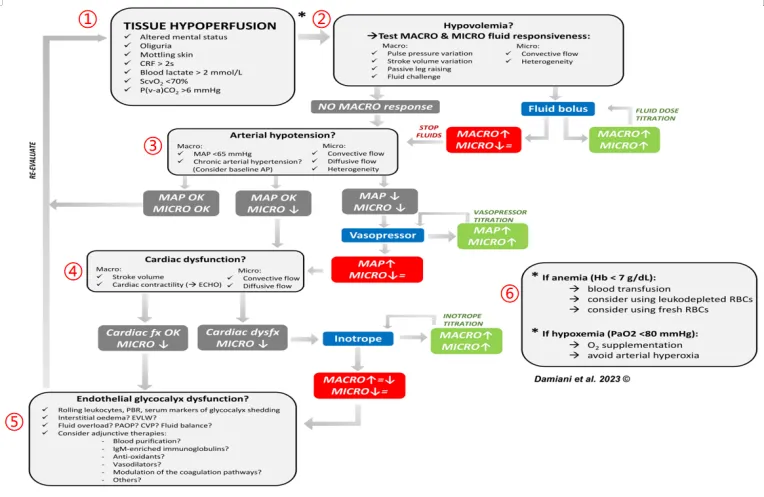
对于改善脓毒症微循环障碍的策略包括: ①血液净化吸附, 保护内皮、恢复血管屏障; ②改善微循环的药物, 包括抗凝/抗血小板治疗, 扩血管治疗, 654-2, 激素, 维生素C, 白蛋白, 血浆, 罂粟碱, 免疫球蛋白; ③保温及其他措施。
参考文献
作者介绍
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信