登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:张春红
单位:温州医科大学附属第一医院药学部

一
铜绿假单胞菌感染现状与耐药机制
铜绿假单胞菌(Pseudomonas aeruginosa,PA)是比较常见的一种医院内感染致病菌,并且几乎所有感染都与宿主防御能力受损有关,常见的危险因素有:创伤、机械通气、手术、严重烧伤、免疫功能低下、糖尿病、老年、慢阻肺、囊性纤维化等。PA可在患有严重基础疾病的患者中引起各种严重的机会性感染,是引发肺炎、血流感染、伤口感染等多种感染的重要病原菌。
PA的耐药机制复杂多样,包括:产β-内酰胺酶、外排泵高表达、膜通透性下降、携带氨基糖苷类修饰酶基因(质粒编码或染色体编码)、靶位点改变、LPS修饰等,我们很难通过药敏报告单推导其耐药机制。而且其耐药机制动态变化,原来测得的“敏感”可能会变为“耐药”,而原来的“耐药”也可能会变为“敏感”。因此,实验室对重复分离到的PA需要重新进行药敏试验。
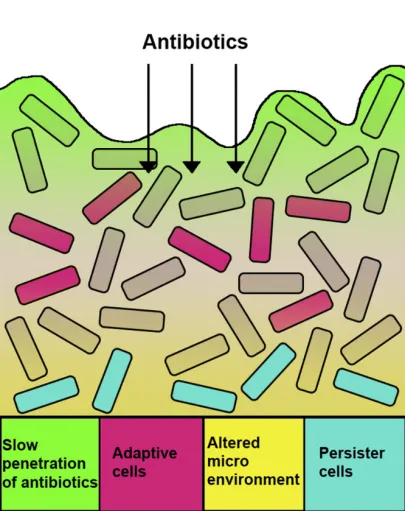
图1 生物被膜介导的抗生素耐药机制
图源:Biotechnol Adv, 2019, 37(1):177-192.
二
铜绿假单胞菌抗菌药物治疗选择
尽管PA对碳青霉烯类抗生素耐药,但对其他β-内酰胺类抗生素物几乎都敏感,所以针对PA的可选药物有很多。
目前可用于治疗PA感染的药物包括β-内酰胺类(如:头孢他啶、哌拉西林-他唑巴坦、头孢哌酮-舒巴坦、美罗培南、亚胺培南、头孢他啶-阿维巴坦)、氨基糖苷类(如:阿米卡星、依替米星、妥布霉素)、氟喹诺酮类(如:环丙沙星、左氧氟沙星)、多黏菌素类[如:多黏菌素E甲磺酸钠(CMS)、硫酸黏菌素、硫酸多黏菌素B]以及磷霉素钠等。
2. 不同感染的治疗
2020年Clin Infect Dis杂志发表的一项多中心回顾性研究比较了头孢他啶、碳青霉烯类和哌拉西林-他唑巴坦单药治疗的疗效差异。研究纳入9个国家25个中心2009—2015年期间接受β-内酰胺类单药物治疗PA菌血症住院患者,将单一疗法类型作为自变量,主要终点是30天全因死亡率。结果显示:头孢他啶、碳青霉烯类和哌拉西林-他唑巴坦单一疗法30天死亡率无显著差异,不良反应无区别,诱导PA耐药亦无区别,但碳青霉烯组诱导PA耐药发生率相对较高。这项研究带给我们一些启示:如果是全敏感的PA,在不考虑经济费用和抗菌药物管理等因素的情况下,单纯从疗效出发,头孢他啶、碳青霉烯类和哌拉西林-他唑巴坦针对PA血流感染没有区别。
病例1:难治性耐药铜绿假单胞菌(DTR-PA)脊柱感染。患者男性,78岁,肺结核病史,已规范治疗,慢性肾功能不全。最初考虑PA肺脓肿(全耐药),初始治疗方案为头孢他啶、哌拉西林-他唑巴坦,CT定位下阿米卡星局部注入,咳嗽咳脓痰症状缓解,病情好转。10月余后胸背部疼痛,MRI提示脊柱感染,考虑PA感染。予美罗培南1 g ivgtt q6h延长输注4小时+手术,美罗培南Cmin 38.58 μg/ml。申请药学部会诊,会诊意见:美罗培南浓度高,但患者未出现中枢神经系统及消化系统不良反应,亦未见神经功能和肾功能进一步恶化。考虑DTR-PA脊柱感染,无需剂量调整;考虑生物膜形成及药物可及性,建议联合磷霉素钠4 g ivgtt q6h。患者经过6周多的治疗,病情好转。
病例2:耐碳青霉烯铜绿假单胞菌(CRPA)血流感染。患者男性,26岁,急性髓系白血病,肝肾功能正常,青霉素过敏史(皮疹),第一次化疗后粒缺,泊沙康唑片预防,经验性予亚胺培南西司他丁,3天后联合万古霉素,但体温反复。患者高热,畏寒寒战,无咳嗽咳痰,无腹痛腹泻,无尿频尿急,血培养结果为PA,亚胺培南(R),美罗培南(R),哌拉西林-他唑巴坦(R),头孢他啶(S)(MIC 8 μg/ml),阿米卡星(S)(MIC 4 μg/ml),左氧氟沙星(R),黏菌素(S)。治疗方案:头孢他啶2 g ivgtt q8h+阿米卡星0.9 g qd,后背出现脓肿,穿刺培养亦是PA,左腹股沟处及前胸先后出现红色结节。体温无好转,但畏寒寒战减少,粒细胞缓慢上升,胸部CT提示右肺感染,阿米卡星Cmax 28 μg/ml。治疗方案更改:头孢他啶-阿维巴坦2.5 g ivgtt q8h延长输注4小时,好转。
病例3:CRPA肺部感染。患者男性,41岁,肝癌术后,肺继发恶性肿瘤,肝硬化肺部感染。3个月前肺部感染,痰培养结果为PA(全耐药),住院期间予头孢哌酮-舒巴坦+阿米卡星效果不佳,改为头孢他啶-阿维巴坦+阿米卡星,疗效好。2个月前再次肺部感染,痰培养结果为DTR-PA,予美罗培南延长输注+阿奇霉素,效果欠佳,改为美罗培南+多黏菌素B,病情稍好转后出现多黏菌素B过敏。后续再次因肺部感染入院,痰培养为DTR-PA(头孢他啶-阿维巴坦MIC 8 μg/ml,临界敏感;环丙沙星I)。头孢哌酮-舒巴坦治疗后咳嗽咳黄脓痰无缓解。申请会诊,建议:首选头孢他啶-阿维巴坦+环丙沙星,次选美罗培南延长输注+环丙沙星。头孢他啶-阿维巴坦延长输注4小时。
4. 联合治疗与单药治疗
对于PA感染,选择单药治疗还是联合治疗通常面临着很大的挑战。联合用药多见于危重症感染,且为经验用药,有生物膜,单药诱导耐药等情况下。而单药治疗多为轻症感染,目标治疗,并且被大多数权威指南推荐。2024年美国传染病学会(IDSA)指南推荐,对于DTR-PA,首选药物均为新型酶抑制剂,只有在膀胱炎中提及妥布霉素或阿米卡星单剂量(表1),而我们国内目前可选的新型酶抑制剂只有头孢他啶-阿维巴坦。
2022年欧洲临床微生物学和传染病学会(ESCMID)发布的《多重耐药革兰阴性杆菌感染治疗指南》更具有实操性,也更接近于我国的实际情况。对于CRPA联合疗法,由于缺乏证据,该指南无法推荐使用新的β-内酰胺酶抑制剂(头孢他啶-阿维巴坦,头孢洛扎-他唑巴坦)或头孢地洛联合疗法治疗CRPA感染。当使用多黏菌素、氨基糖苷类或磷霉素治疗由CRPA引起的严重感染时,建议使用两种在体外有效的药物进行治疗。无法提供关于特定组合的推荐或反对意见。在非严重或低风险CRPA感染患者中,在考虑抗生素管理的情况下,指南认为根据感染来源在个体基础上使用从具有体外活性的药物中选择的单药治疗是良好的临床实践。
2022年中华医学会呼吸病学分会感染学组发表的《中国铜绿假单胞菌下呼吸道感染诊治专家共识(2022年版)》中,对于CRPA或DTR-PA的目标治疗,首选头孢洛扎-他唑巴坦、头孢他啶-阿维巴坦、亚胺培南-西司他丁雷利巴坦、美罗培南-法硼巴坦±氟喹诺酮类/氨基糖苷类;以多黏菌素类为基础的联合治疗。
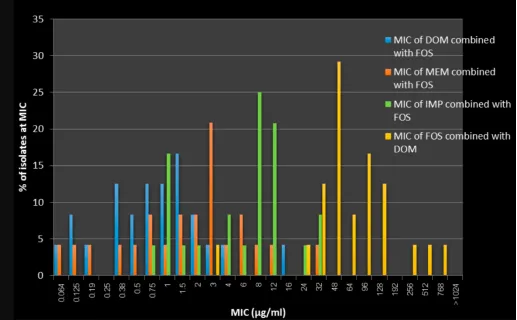
图3 CRPA联合用药的MIC分布
2018年发表的一项回顾性分析纳入215例CRPA感染患者,分析单药和联合治疗是否存在差异,单药治疗以头孢吡肟、哌拉西林-他唑巴坦为主。结果显示:多数CRPA对抗PA的其他β-内酰胺类药物仍敏感。呼吸道感染相关的死亡风险显著升高,尿路感染死亡风险降低。联合治疗和单药治疗的死亡率无差异,但氨基糖苷类单药治疗与死亡风险增加有关,在多个感染部位均一致。
2018年发表的另一项回顾性队列研究纳入136例泛耐药铜绿假单胞菌(XDR-PA)【仅对黏菌素和或磷霉素敏感】肺炎患者,结果发现黏菌素联合延长输注高剂量多利培南/磷霉素,可显著降低死亡率。2024年发表的一项回顾性研究比较头孢他啶-阿维巴坦单药和联合治疗CRPA和DTR-PA引起的严重医院获得性肺炎的临床疗效。研究纳入84例严重医院获得性肺炎患者,其中39例CRPA感染,45例DTR-PA感染。53例(63.1%)患者接受头孢他啶-阿维巴坦单药治疗,31患者(36.9%)为联合治疗。临床治愈率总计为63.1%。单药治疗与联合治疗[联合药物包括喹诺酮类、环丙沙星、多黏菌素B(静脉/雾化)、阿米卡星、氨曲南]的患者之间的研究结局无显著差异。负荷剂量,延长输注(>4小时)或持续输注与临床治愈率相关。肾功能不全和CRRT时剂量下调与临床预防不良相关。
2023年Crit Care杂志发表了一项评估抗生素联合治疗是否在减少PA所致呼吸机相关肺炎患者复发和死亡方面优于单药治疗的研究,纳入169例患者,其中113例(66.9%)患者接受经验性联合治疗,75例(44.4%)患者接受目标性联合抗菌药物治疗。单药治疗方案为一种活性抗菌素(β-内酰胺、氟喹诺酮或黏菌素);联合治疗方案为β-内酰胺和氨基糖苷/氟喹诺酮或氟喹诺酮和氨基糖苷。结果显示:联合治疗组患者的结局与单药治疗组相似。该研究排除了妊娠及免疫抑制(AIDS、免疫抑制治疗、皮质类固醇>0.5 mg/kg·d,持续1个月以上)患者。但在ICU中,免疫抑制患者可能占多数。所以该研究结论是否适用于ICU中的免疫缺陷患者,仍有待探讨。
表2 CLSI指南中PA药物的敏感折点
以往,PA的β-内酰胺类药物折点高于肠杆菌科的折点,FDA注明这些β-内酰胺类药物应与一种氨基糖苷类药物联用。当使用新的折点,菌株若对β-内酰胺类敏感且非重症,可不需再联合治疗。
三
铜绿假单胞菌生物膜的治疗
PA生物膜的治疗主要包括以下:①抑制生物膜形成:阿奇霉素,亚抑菌浓度抗菌药物(头孢他啶、环丙沙星),新型抗菌物质;②破坏生物膜:藻酸盐裂解酶(藻酸盐是生物膜的重要组成成分,也是黏液型PA的毒力因子,是引起持续性感染的一大因素);③联合抗感染。
2022年发表在Antibiotics杂志的一篇文章介绍了3例PA耳鼻喉感染的门诊治疗病例,2例鼻窦炎和1例外耳炎,使用阿奇霉素0.5 g po qd,疗程3~8周不等,治疗有效,可能原因为阿奇霉素破坏了PA的生物膜。还有一例40岁骨髓增生异常综合征患者,MDR-PA坏死性筋膜炎,予哌拉西林-他唑巴坦(MIC 64 μg/ml)4.5 g ivgtt q6h+阿奇霉素0.5 g ivgtt qd抗感染,治疗有效。但究竟是阿奇霉素破坏了PA的生物膜还是药物本身的免疫调节作用尚不清楚。
病例4:患者女性,77岁,支气管扩张10余年,反复咳嗽咳痰,多次住院治疗,多种广谱抗菌药物使用。20天前再次咳嗽咳痰加重伴发热,呼吸困难入院,因呼吸衰竭予呼吸机辅助呼吸。多次痰培养提示CRPA(黏液性),药敏报告动态变化,先后予哌拉西林-他唑巴坦、亚胺培南-西司他汀、头孢哌酮-舒巴坦+阿米卡星、比阿培南抗感染。转至普通病房后仍发热,申请临床药学会诊,会诊建议:哌拉西林-他唑巴坦4.5 g ivgtt q6h+阿奇霉素0.5 g qd。
四
小结
参考文献
作者介绍
张春红
温州医科大学附属第一医院药学部副主任,副主任药师;国家卫健委临床药师培训基地带教老师,负责抗感染专业带教工作;中国医药教育协会药学服务专业委员会委员,中国医药教育协会临床微生物专业委员会委员,浙江省药学会微生物耐药与控制专业委员会委员,浙江省药学会医院药学专业委员会抗感染学组委员,浙江省毒理学会临床药物治疗安全专业委员会委员,浙江省药理学会TDM研究专业委员会委员,温州市医学会细菌感染与耐药防治分会委员;主要从事相关感染物选择及剂量调整,抗菌药物TDM的解读。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信