登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
文章来源于华西呼吸治疗公众号
为规范iNO疗法的临床应用,由中华医学会呼吸病学分会呼吸治疗学组与中国医师协会呼吸医师分会呼吸职业发展委员会呼吸治疗师工作组组织、我院呼吸治疗科梁国鹏教授团队牵头起草了《一氧化氮吸入疗法临床应用专家共识》。

吸入一氧化氮(inhaled nitric oxide, iNO)作为一种选择性肺血管扩张剂,有舒张肺血管、增加肺血流、降低肺动脉压力以及改善氧合等作用。在发达国家,iNO已成为治疗新生儿持续性肺动脉高压(persistent pulmonary hypertension of the newborn, PPHN)的常规治疗手段。iNO治疗也被用于儿童和成人呼吸衰竭和肺动脉高压(pulmonary hypertension, PH),已被证明可以有效降低肺动脉压和改善氧合。随着iNO疗法临床应用的增加,市面上的iNO设备也逐渐增多,但设备品牌繁杂、设备间性能差异大以及连接和设置各异等问题使得iNO设备的规范使用存在困难;同时,iNO治疗过程中可能出现不良反应,如iNO可导致高铁血红蛋白(methemoglobinemia,MetHb)血症,还可与O2结合产生毒性代谢产物NO2等情况。所以,该疗法在临床的安全性和有效性可能会受到上述因素的影响。为规范iNO疗法的临床应用,中华医学会呼吸病学分会呼吸治疗学组与中国医师协会呼吸医师分会呼吸职业发展委员会呼吸治疗师工作组组织相关专家,根据最新的研究进展和临床操作经验提出了iNO疗法临床应用专家共识,以提高该治疗的安全性和有效性。
一
共识制定方法
本共识由中华医学会呼吸病学分会呼吸治疗学组和中国医师协会呼吸医师分会呼吸职业发展委员会呼吸治疗师工作组发起,启动时间为2023年4月,写作时间7个月。
为了促进共识的传播和临床应用,共识将在专业期刊上发表,发表后将以学术会议、学习班等形式在全国范围进行传播。共识制订工作组将定期进行文献检索、证据更新和评价,计划每 3~5 年对共识进行更新。
二
iNO治疗概述
iNO的主要生理学作用是舒张肺血管、降低肺动脉压力,其机制主要是通过环磷酸鸟苷途径造成细胞内钙离子浓度降低,从而引起血管扩张[11-12]。与静脉输注血管扩张剂相比,iNO可在PH患者中产生选择性肺血管扩张作用,而不会导致全身血管扩张和严重的全身性低血压。大多数临床试验都表明治疗剂量下的iNO具有相对较少的全身不良反应,并且没有明显的毒性。此外,iNO还具有改善低氧的生理学作用[3]。在低氧患者中,缺氧区域的肺血管床会收缩,从而重新分配血流朝向通气较好、肺泡内氧分压较高的肺区。有研究显示,iNO可增加这部分患者通气良好肺区的血流,从而改善通气/血流比(ventilation/perfusion ratio, V/Q),减少分流,改善氧合[4]。iNO还有下调白细胞反应、增加细胞保护、抗感染、减少血小板聚集、促进神经传递、促进组织再生、增强支气管扩张等作用[13-14]。
三
iNO疗法的适应证和禁忌证
根据目前的相关指南推荐及临床研究情况,iNO疗法在新生儿领域主要应用于多种原因导致的PPHN和低氧血症,其中足月或近足月(胎龄>34周)的PPHN是唯一批准的适应证[3, 15]。iNO在早产儿领域的应用仍存在争议,指南推荐对于明确由PPHN而非实质性肺病引起的严重低氧血症的早产儿可尝试采用iNO疗法[16-17]。iNO疗法在新生儿领域应用的禁忌证为:①严重的左心发育不良,或动脉导管依赖的先天性心脏病(congenital heart disease,CHD);②致命性的先天性缺陷和充血性心力衰竭;③先天性MetHb血症;④严重出血,如颅内出血、脑室内出血、肺出血[15]。在儿童及成人领域,iNO疗法主要应用于CHD、围手术期(心胸外科手术、体外膜氧合、移植、心室辅助等)、各种原因导致的急性低氧型呼吸衰竭或急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)以及慢性肺疾病、心脏骤停等情况[4-5,7-8,14]。iNO也常用于急性血管反应试验[8,18],以筛选出对口服高剂量钙通道阻滞剂有效的患者;对于左心疾病相关PH患者,此项试验仅限于评估患者是否具备心脏移植的候选资格,而对于结构性心脏病伴有初始体肺分流的PH患者,可通过该试验来评估缺损闭合的可能性。关于iNO的临床适用人群参考可见表1。尽管在临床环境中iNO已得到广泛应用,且体现出了有益作用,但目前仍然缺乏高质量的研究证据。
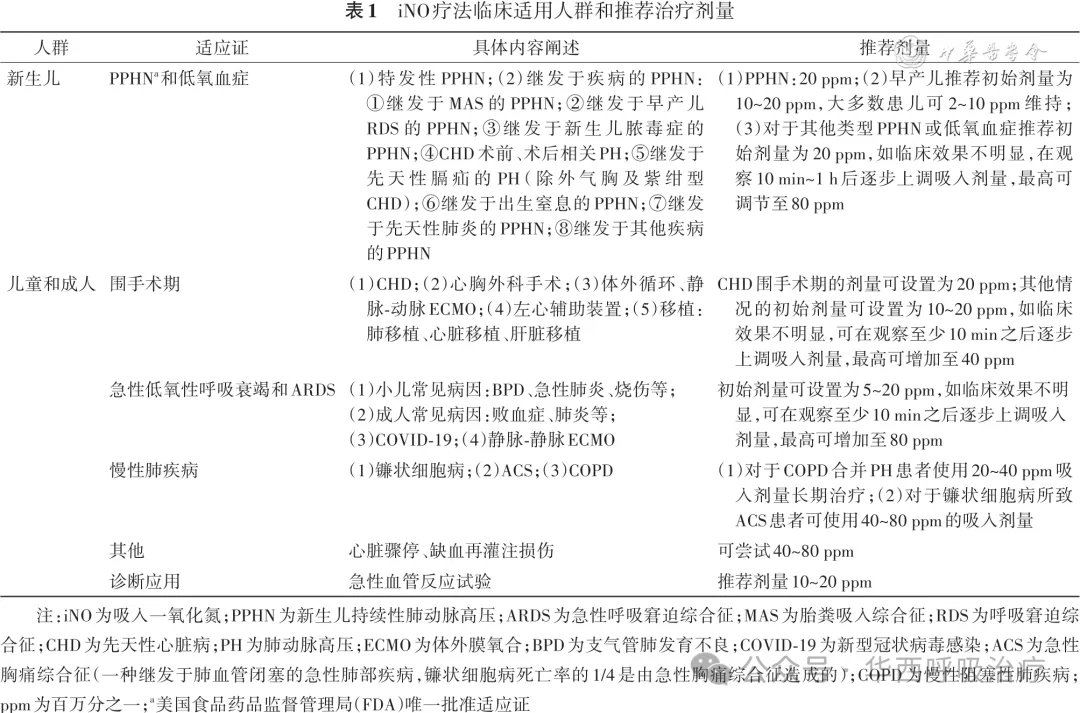
专家共识1:iNO疗法唯一批准的适应证为PPHN,但临床上已广泛应用于多种原因导致的PH或低氧血症患者,建议对这些患者充分评估其是否存在相关禁忌证后谨慎使用。
四
iNO相关治疗设备和连接
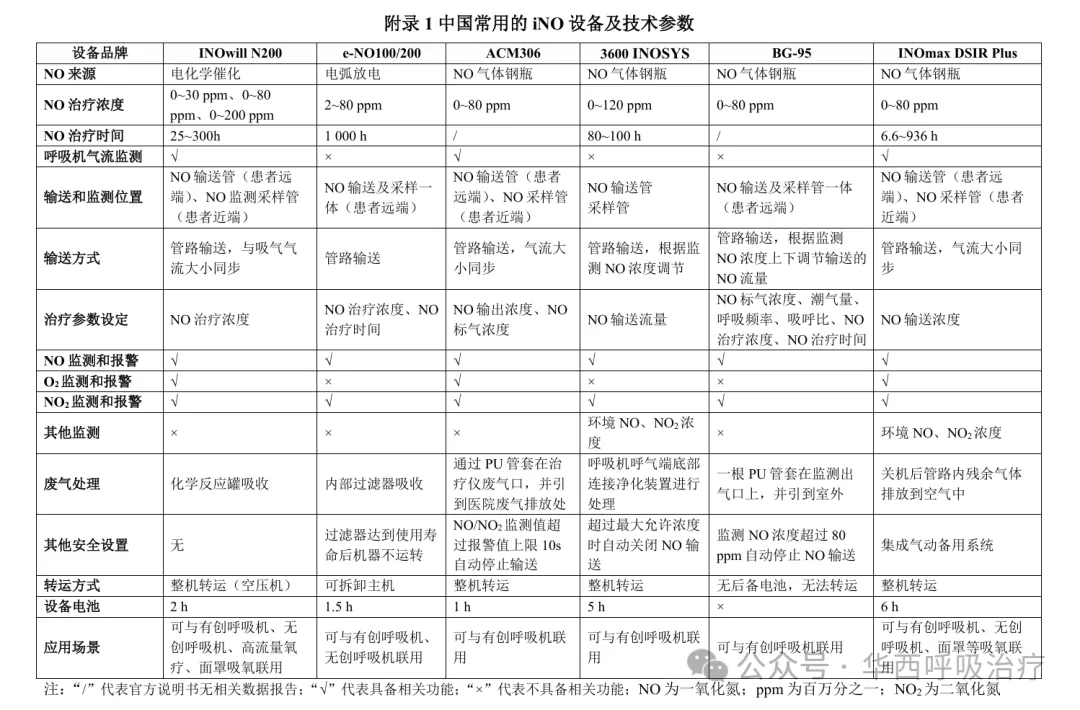
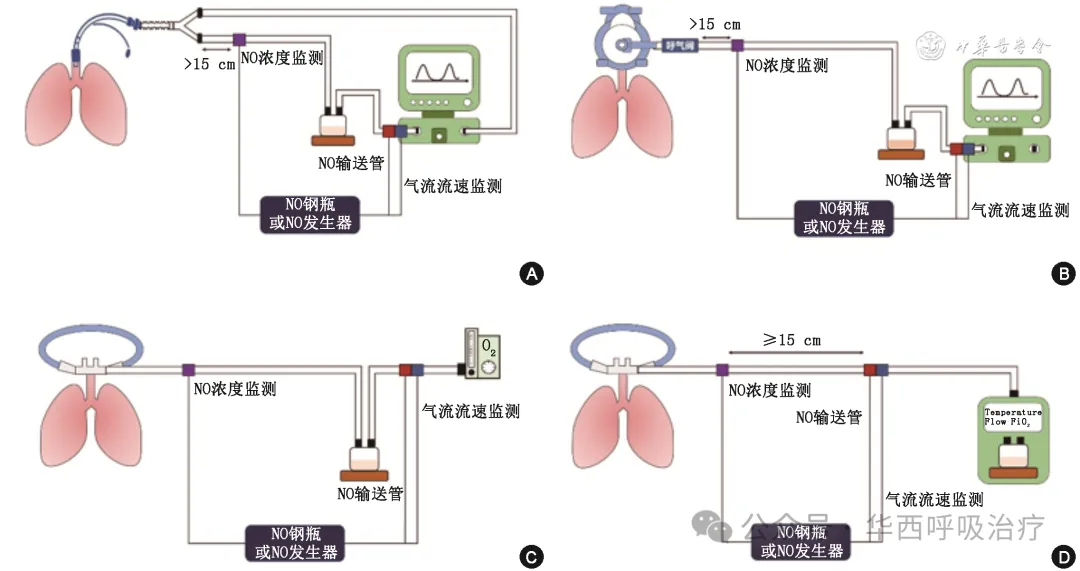
专家共识3:建议iNO设备连接时,将输入端放于吸气肢远离患者处,监测采样端放于吸气肢靠近患者处。采样端需与输入端和呼吸机回路Y型端或呼气阀(若有)保持一定距离(>15 cm),以免监测值受到干扰。
五
iNO剂量选择和疗效评估
专家共识5:iNO 起效迅速,建议在治疗开始后 30~60 min应进行疗效评估,对 iNO疗法无反应者应及时调整治疗方案,对调整后仍然表现为无反应甚至出现负反应的患者,应立即停用 iNO。
六
iNO治疗时的不良反应
专家共识6:在iNO治疗过程中建议对患者进行安全性监测,如果在治疗量下出现MetHb血症、反跳性PH和反跳性低氧血症等不良反应,应立即调整iNO治疗方案或停止iNO治疗。
七
职业防护
专家共识7:iNO设备在使用过程中,可能因气体泄漏导致相关医务人员出现职业暴露,危害身体健康,建议iNO使用过程中常规监测环境中的NO和NO2浓度。
八
iNO患者转运
专家共识8:iNO患者转运途中,建议保证iNO治疗连续性并持续对管路和环境中NO、NO2浓度进行监测,避免气体泄漏等重大危险事件的发生,同时,临床应制订规范化转运流程和紧急情况处理预案,并于日常工作中加强相关流程演练,以保证患者和医务人员安全。
九
iNO的撤离
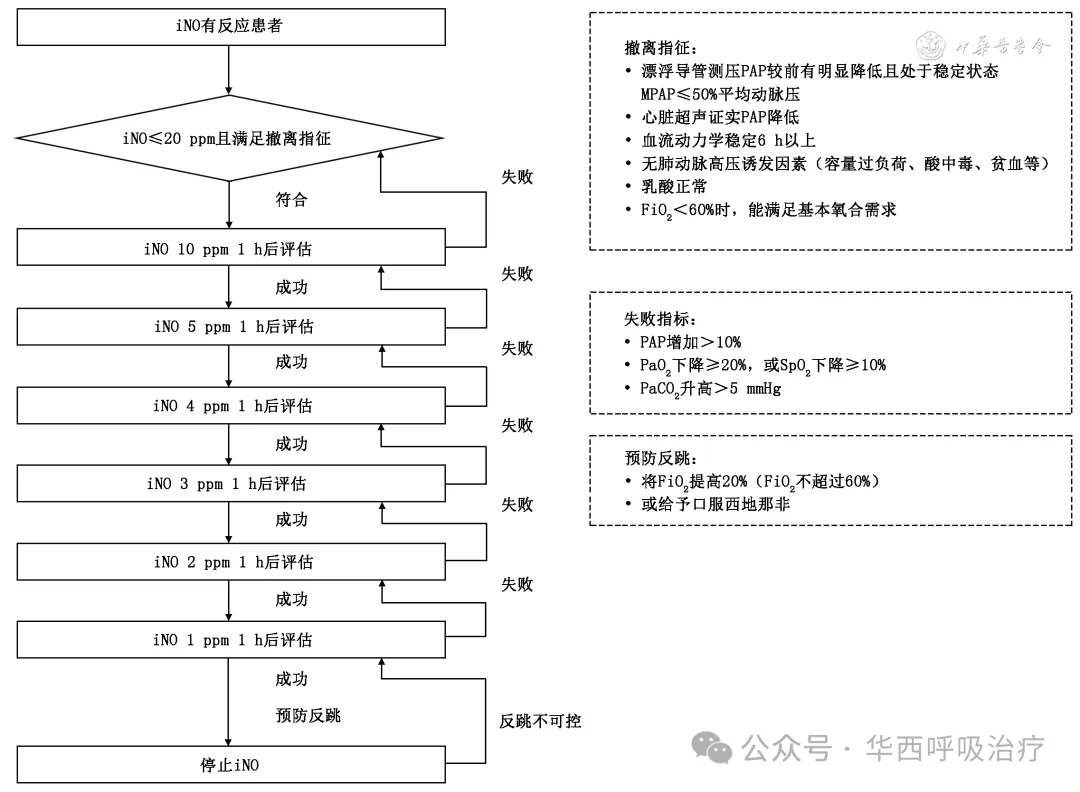
专家共识9:撤离iNO时,建议严格按照撤离流程逐步降低iNO浓度,并密切监测患者呼吸和循环状态,做好反跳性PH和反跳性低氧血症的预防和处理。
十
清洁消毒和维护保养
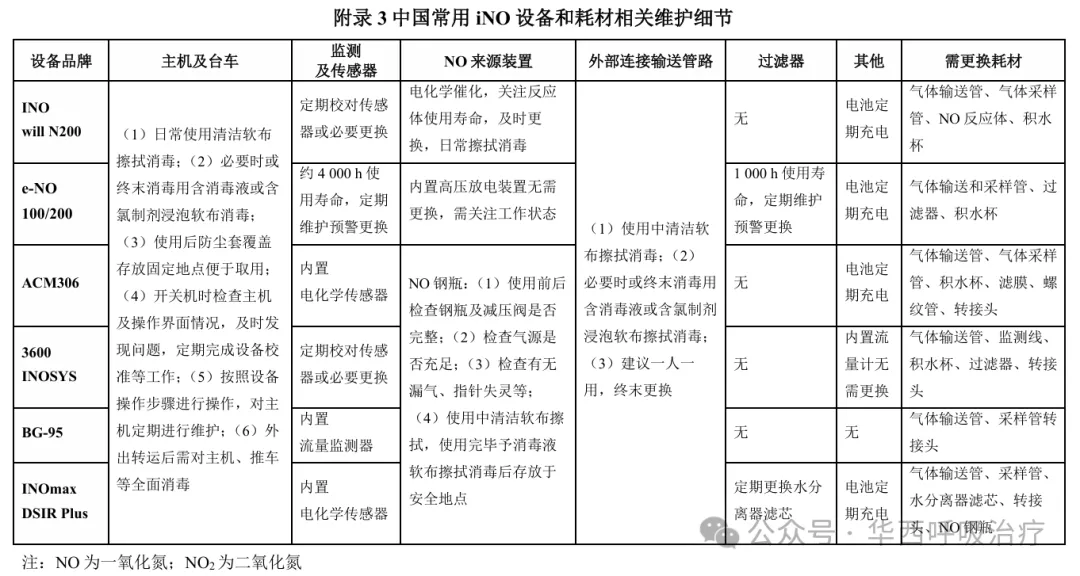
专家共识10:建议对iNO设备和耗材进行日常清洁消毒和定期维护保养,保证监测准确、运行状态良好,以防止意外情况发生、避免交叉感染、延长设备使用寿命。
十一
iNO应用流程和记录
共识审校专家组(以姓氏汉语拼音排序):鲍彰(浙江大学医学院附属第一医院呼吸与危重症医学科);陈成(苏州大学附属第一医院呼吸与危重症医学科);董霄松(北京大学人民医院呼吸与危重症医学科);傅立军(上海交通大学医学院附属上海儿童医学中心心内科);韩锋锋(上海交通大学医学院附属新华医院呼吸与危重症医学科);黄蓉(北京协和医院呼吸与危重症医学科);黄絮(中日友好医院呼吸与危重症医学科);蒋进军(复旦大学附属中山医院呼吸与危重症医学科);姜蓉(上海市肺科医院肺循环科);居旻杰(复旦大学附属中山医院重症医学科);李惠萍(深圳市人民医院呼吸与危重症医学科);罗凤鸣(四川大学华西医院);梁国鹏(四川大学华西医院呼吸治疗科);刘嘉琳(上海交通大学医学院附属瑞金医院老年科);黎毅敏(广州医科大学附属第一医院);刘玉琪(福建医科大学附属第二医院重症医学科);马江伟(中国医科大学附属第一医院呼吸与危重症医学科);宋立强(第四军医大学西京医院呼吸与危重症医学科);屠国伟(复旦大学附属中山医院心脏重症监护中心);王胜昱(西安医学院第一附属医院);王伟(武汉大学中南医院呼吸与危重症医学科);解立新(解放军总医院第八医学中心呼吸与危重症医学部);夏金根(中日友好医院呼吸与危重症医学科);肖坤(解放军总医院第八医学中心呼吸与危重症医学部);赵卉(山西医科大学第二医院呼吸与危重症医学科);赵建平(华中科技大学同济医学院附属同济医院呼吸与危重症医学科);郑春燕(山东大学齐鲁医院全科医学科)
参考文献
[1] Palmer RM, Ferrige AG, Moncada S. Nitric oxide release accounts for the biological activity of endothelium-derived relaxing factor[J]. Nature, 1987, 327(6122):524-526. DOI: 10.1038/327524a0IF: 50.5 Q1 .
[2] Frostell C, Fratacci MD, Wain JC, et al. Inhaled nitric oxide. A selective pulmonary vasodilator reversing hypoxic pulmonary vasoconstriction[J]. Circulation, 1991, 83(6):2038-2047. DOI: 10.1161/01.cir.83.6.2038IF: 35.5 Q1 .
[3] DiBlasi RM, Myers TR, Hess DR. Evidence-based clinical practice guideline: inhaled nitric oxide for neonates with acute hypoxic respiratory failure[J]. Respir Care, 2010, 55(12):1717-1745.
[4] Griffiths MJ, Evans TW. Inhaled nitric oxide therapy in adults[J]. N Engl J Med, 2005, 353(25):2683-2695. DOI: 10.1056/NEJMra051884IF: 96.2 Q1 .
[5] Bhatraju P, Crawford J, Hall M, et al. Inhaled nitric oxide: Current clinical concepts[J]. Nitric Oxide, 2015, 50:114-128. DOI: 10.1016/j.niox.2015.08.007IF: 3.2 Q2 .
[6] Kuch BA, Saville AL, Sanchez De Toledo J, et al. Inhaled pulmonary vasodilators: are there indications within the pediatric ICU?[J]. Respir Care, 2017, 62(6):678-698. DOI: 10.4187/respcare.05360IF: 2.4 Q2 .
[7] Liu K, Wang H, Yu SJ, et al. Inhaled pulmonary vasodilators: a narrative review[J]. Ann Transl Med, 2021, 9(7):597. DOI: 10.21037/atm-20-4895.
[8] Redaelli S, Magliocca A, Malhotra R, et al. Nitric oxide: clinical applications in critically ill patients[J]. Nitric Oxide, 2022, 121:20-33. DOI: 10.1016/j.niox.2022.01.007IF: 3.2 Q2 .
[9] Macrae DJ, Field D, Mercier JC, et al. Inhaled nitric oxide therapy in neonates and children: reaching a European consensus[J]. Intensive Care Med, 2004, 30(3):372-380. DOI: 10.1007/s00134-003-2122-3IF: 27.1 Q1 .
[10] Cuthbertson BH, Dellinger P, Dyar OJ, et al. UK guidelines for the use of inhaled nitric oxide therapy in adult ICUs. American-European Consensus Conference on ALI/ARDS[J]. Intensive Care Med, 1997, 23(12):1212-1218. DOI: 10.1007/s001340050488IF: 27.1 Q1 .
[11] Ichinose F, Roberts JD Jr, Zapol WM. Inhaled nitric oxide: a selective pulmonary vasodilator: current uses and therapeutic potential[J]. Circulation, 2004, 109(25):3106-3111. DOI: 10.1161/01.CIR.0000134595.80170.62IF: 35.5 Q1 .
[12] Rossaint R, Pison U, Gerlach H, et al. Inhaled nitric oxide: its effects on pulmonary circulation and airway smooth muscle cells[J]. Eur Heart J, 1993, 14 Suppl I:133-140.
[13] Mathru M, Huda R, Solanki DR, et al. Inhaled nitric oxide attenuates reperfusion inflammatory responses in humans[J]. Anesthesiology, 2007, 106(2):275-282. DOI: 10.1097/00000542-200702000-00015IF: 9.1 Q1 .
[14] Redaelli S, Pozzi M, Giani M, et al. Inhaled nitric oxide in acute respiratory distress syndrome subsets rationale and clinical applications[J]. J Aerosol Med Pulm Drug Deliv, 2023, 36(3):112-126. DOI: 10.1089/jamp.2022.0058IF: 2.0 Q3 .
[15] 中国医师协会新生儿科医师分会. 一氧化氮吸入治疗在新生儿重症监护病房的应用指南(2019版)[J]. 发育医学电子杂志, 2019, 7(4):241-248. DOI: 10.3969/j.issn.2095-5340.2019.04.001.
[16] Cole FS, Alleyne C, Barks JD, et al. NIH Consensus Development Conference statement: inhaled nitric-oxide therapy for premature infants[J]. Pediatrics, 2011, 127(2):363-369. DOI: 10.1542/peds.2010-3507IF: 6.2 Q1.
[17] Kinsella JP, Steinhorn RH, Krishnan US, et al. Recommendations for the use of inhaled nitric oxide therapy in premature newborns with severe pulmonary hypertension[J]. J Pediatr, 2016, 170:312-314. DOI: 10.1016/j.jpeds.2015.11.050IF: 3.9 Q1 .
[18] Sherlock LG, Wright CJ, Kinsella JP, et al. Inhaled nitric oxide use in neonates: balancing what is evidence-based and what is physiologically sound[J]. Nitric Oxide, 2020, 95:12-16. DOI: 10.1016/j.niox.2019.12.001IF:3.2Q2 .
[19] Francoe M, Troncy E, Blaise G. Inhaled nitric oxide: technical aspects of administration and monitoring[J]. Crit Care Med, 1998, 26(4):782-796. DOI: 10.1097/00003246-199804000-00033IF: 7.7 Q1 .
[20] Troncy E, Francoeur M, Blaise G. Inhaled nitric oxide delivery systems[J]. Anesthesiology, 1997, 87(6):1591-1593. DOI: 10.1097/00000542-199712000-00054IF: 9.1 Q1 .
[21] Young JD, Dyar OJ. Delivery and monitoring of inhaled nitric oxide[J]. Intensive Care Med, 1996, 22(1):77-86. DOI: 10.1007/BF01728336IF: 27.1 Q1 .
[22] Gianni S, Carroll RW, Kacmarek RM, et al. Inhaled Nitric Oxide Delivery Systems for Mechanically Ventilated and Nonintubated Patients: A Review[J]. Respir Care, 2021, 66(6):1021-1028. DOI: 10.4187/respcare.08856IF: 2.4 Q2 .
[23] 中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会. 新生儿肺动脉高压诊治专家共识[J]. 中华儿科杂志, 2017, 55(3):163-168. DOI: 10.3760/cma.j.issn.0578-1310.2017.03.002.
[24] Barrington KJ, Finer N, Pennaforte T, et al. Nitric oxide for respiratory failure in infants born at or near term[J]. Cochrane Database Syst Rev, 2017, 1(1):CD000399. DOI: 10.1002/14651858.CD000399.pub3IF: 8.8 Q1 .
[25] Christou H, Van Marter LJ, Wessel DL, et al. Inhaled nitric oxide reduces the need for extracorporeal membrane oxygenation in infants with persistent pulmonary hypertension of the newborn[J]. Crit Care Med, 2000, 28(11):3722-3727. DOI: 10.1097/00003246-200011000-00031IF: 7.7 Q1 .
[26] American Academy of Pediatrics. Committee on Fetus and Newborn. Use of inhaled nitric oxide [J]. Pediatrics, 2000, 106(2 Pt 1):344-345.
[27] Davidson D, Barefield ES, Kattwinkel J, et al. Inhaled nitric oxide for the early treatment of persistent pulmonary hypertension of the term newborn: a randomized, double-masked, placebo-controlled, dose-response, multicenter study. The I-NO/PPHN Study Group[J]. Pediatrics, 1998, 101(3 Pt 1):325-334.DOI: 10.1542/peds.101.3.325IF: 6.2 Q1 .
[28] Finer NN, Etches PC, Kamstra B, et al. Inhaled nitric oxide in infants referred for extracorporeal membrane oxygenation: dose response[J]. J Pediatr, 1994, 124(2):302-308. DOI: 10.1016/s0022-3476(94)70324-8IF: 3.9 Q1 .
[29] Demirakça S, Dötsch J, Knothe C, et al. Inhaled nitric oxide in neonatal and pediatric acute respiratory distress syndrome: dose response, prolonged inhalation, and weaning[J]. Crit Care Med, 1996, 24(11):1913-1919. DOI: 10.1097/00003246-199611000-00024IF: 7.7 Q1 .
[30] Cornfield DN, Maynard RC, deRegnier RA, et al. Randomized, controlled trial of low-dose inhaled nitric oxide in the treatment of term and near-term infants with respiratory failure and pulmonary hypertension[J]. Pediatrics, 1999, 104(5 Pt 1):1089-1094. DOI: 10.1542/peds.104.5.1089IF: 6.2 Q1 .
[31] Campbell BT, Herbst KW, Briden KE, et al. Inhaled nitric oxide use in neonates with congenital diaphragmatic hernia[J]. Pediatrics, 2014, 134(2):e420-426. DOI: 10.1542/peds.2013-2644IF: 6.2 Q1 .
[32] Konduri GG, Solimano A, Sokol GM, et al. A randomized trial of early versus standard inhaled nitric oxide therapy in term and near-term newborn infants with hypoxic respiratory failure[J]. Pediatrics, 2004, 113(3 Pt 1):559-564. DOI: 10.1542/peds.113.3.559IF: 6.2 Q1 .
[33] Field D, Elbourne D, Hardy P, et al. Neonatal ventilation with inhaled nitric oxide vs. ventilatory support without inhaled nitric oxide for infants with severe respiratory failure born at or near term: the INNOVO multicentre randomised controlled trial[J]. Neonatology, 2007, 91(2):73-82. DOI: 10.1159/000097123IF: 2.6 Q1 .
[34] Wessel DL, Adatia I, Van Marter LJ, et al. Improved oxygenation in a randomized trial of inhaled nitric oxide for persistent pulmonary hypertension of the newborn[J]. Pediatrics, 1997, 100(5):E7. DOI: 10.1542/peds.100.5.e7IF: 6.2 Q1 .
[35] Inhaled nitric oxide in full-term and nearly full-term infants with hypoxic respiratory failure[J]. N Engl J Med, 1997, 336(9):597-604. DOI: 10.1056/NEJM199702273360901IF: 96.2 Q1 .
[36] Yates AR, Berger JT, Reeder RW, et al. Characterization of inhaled nitric oxide use for cardiac indications in pediatric patients[J]. Pediatr Crit Care Med, 2022, 23(4):245-254. DOI: 10.1097/PCC.0000000000002917IF: 4.0 Q1.
[37] Schlapbach LJ, Gibbons KS, Horton SB, et al. Effect of Nitric Oxide via Cardiopulmonary Bypass on Ventilator-Free Days in Young Children Undergoing Congenital Heart Disease Surgery: The NITRIC Randomized Clinical Trial[J]. JAMA, 2022, 328(1):38-47. DOI: 10.1001/jama.2022.9376IF: 63.1 Q1 .
[38] 中华医学会小儿外科分会心脏学组, 国家儿童医学中心心血管专科联盟. 儿童先天性心脏病相关性肺高压诊断与治疗指南[J]. 中华小儿外科杂志, 2022, 43(11):966-980. DOI: 10.3760/cma.j.cn421158-20211220-00624.
[39] James C, Millar J, Horton S, et al. Nitric oxide administration during paediatric cardiopulmonary bypass: a randomised controlled trial[J]. Intensive Care Med, 2016, 42(11):1744-1752. DOI: 10.1007/s00134-016-4420-6IF: 27.1 Q1 .
[40] Chiletti R, Horton S, Bednarz A, et al. Safety of nitric oxide added to the ECMO circuit: a pilot study in children[J]. Perfusion, 2018, 33(1):74-76. DOI: 10.1177/0267659117720495IF: 1.1 Q4 .
[41] Potapov E, Meyer D, Swaminathan M, et al. Inhaled nitric oxide after left ventricular assist device implantation: a prospective, randomized, double-blind, multicenter, placebo-controlled trial[J]. J Heart Lung Transplant, 2011, 30(8):870-878. DOI: 10.1016/j.healun.2011.03.005IF: 6.4 Q1 .
[42] Raghunathan V, Mohan N, Dhaliwal M, et al. Pediatric liver transplantation in severe hepatopulmonary syndrome and use of inhaled nitric oxide for post-transplant hypoxemia-a single center experience[J]. Pediatr Transplant, 2020, 24(7):e13792. DOI: 10.1111/petr.13792IF: 1.2 Q3 .
[43] Ghadimi K, Cappiello J, Cooter-Wright M, et al. Inhaled pulmonary vasodilator therapy in adult lung transplant: a randomized clinical trial[J]. JAMA Surg, 2022, 157(1):e215856. DOI: 10.1001/jamasurg.2021.5856IF: 15.7 Q1 .
[44] Hartwig MG, Klapper JA, Poola N, et al. A randomized, multicenter, blinded pilot study assessing the effects of gaseous nitric oxide in an ex vivo system of human lungs[J]. Pulm Ther, 2023, 9(1):151-163. DOI: 10.1007/s41030-022-00209-5IF: 2.3 Q2 .
[45] Fessler J, Godement M, Pirracchio R, et al. Inhaled nitric oxide dependency at the end of double-lung transplantation: a boosted propensity score cohort analysis[J]. Transpl Int, 2019, 32(3):244-256. DOI: 10.1111/tri.13381IF: 2.7 Q1 .
[46] Meade MO, Granton JT, Matte-Martyn A, et al. A randomized trial of inhaled nitric oxide to prevent ischemia-reperfusion injury after lung transplantation[J]. Am J Respir Crit Care Med, 2003, 167(11):1483-1489. DOI: 10.1164/rccm.2203034IF: 19.3 Q1 .
[47] Rossaint R, Falke KJ, López F, et al. Inhaled nitric oxide for the adult respiratory distress syndrome[J]. N Engl J Med, 1993, 328(6):399-405. DOI: 10.1056/NEJM199302113280605IF: 96.2 Q1 .
[48] Taylor RW, Zimmerman JL, Dellinger RP, et al. Low-dose inhaled nitric oxide in patients with acute lung injury: a randomized controlled trial[J]. JAMA, 2004, 291(13):1603-1609. DOI: 10.1001/jama.291.13.1603IF: 63.1 Q1.
[49] Dellinger RP, Zimmerman JL, Taylor RW, et al. Effects of inhaled nitric oxide in patients with acute respiratory distress syndrome: results of a randomized phase II trial. Inhaled Nitric Oxide in ARDS Study Group[J]. Crit Care Med, 1998, 26(1):15-23. DOI: 10.1097/00003246-199801000-00011IF: 7.7 Q1 .
[50] Bronicki RA, Fortenberry J, Schreiber M, et al. Multicenter randomized controlled trial of inhaled nitric oxide for pediatric acute respiratory distress syndrome[J]. J Pediatr, 2015, 166(2):365-369.e1. DOI: 10.1016/j.jpeds.2014.10.011IF: 3.9 Q1 .
[51] Gebistorf F, Karam O, Wetterslev J, et al. Inhaled nitric oxide for acute respiratory distress syndrome (ARDS) in children and adults[J]. Cochrane Database Syst Rev, 2016, 2016(6):CD002787. DOI: 10.1002/14651858.CD002787.pub3IF: 8.8 Q1 .
[52] Lundin S, Mang H, Smithies M, et al. Inhalation of nitric oxide in acute lung injury: results of a European multicentre study. The European Study Group of Inhaled Nitric Oxide[J]. Intensive Care Med, 1999, 25(9):911-919. DOI: 10.1007/s001340050982IF: 27.1 Q1 .
[53] Alqahtani JS, Aldhahir AM, Al Ghamdi SS, et al. Inhaled nitric oxide for clinical management of COVID-19: a systematic review and meta-analysis[J]. Int J Environ Res Public Health, 2022, 19(19):12803. DOI: 10.3390/ijerph191912803.
[54] Mekontso Dessap A, Papazian L, Schaller M, et al. Inhaled nitric oxide in patients with acute respiratory distress syndrome caused by COVID-19: treatment modalities, clinical response, and outcomes[J]. Ann Intensive Care, 2023, 13(1):57. DOI: 10.1186/s13613-023-01150-9IF: 5.7 Q1 .
[55] Di Fenza R, Shetty NS, Gianni S, et al. High-dose inhaled nitric oxide in acute hypoxemic respiratory failure due to COVID-19: a multicenter phase II trial[J]. Am J Respir Crit Care Med, 2023, 208(12):1293-1304. DOI: 10.1164/rccm.202304-0637OCIF: 19.3 Q1 .
[56] Phillips DB, Brotto AR, Ross BA, et al. Inhaled nitric oxide improves ventilatory efficiency and exercise capacity in patients with mild COPD: A randomized-control cross-over trial[J]. J Physiol, 2021, 599(5):1665-1683. DOI: 10.1113/JP280913IF: 4.7 Q1 .
[57] Roger N, Barberà JA, Roca J, et al. Nitric oxide inhalation during exercise in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 1997, 156(3 Pt 1):800-806. DOI: 10.1164/ajrccm.156.3.9611051IF: 19.3 Q1 .
[58] Katayama Y, Higenbottam TW, Diaz de Atauri MJ, et al. Inhaled nitric oxide and arterial oxygen tension in patients with chronic obstructive pulmonary disease and severe pulmonary hypertension[J]. Thorax, 1997, 52(2):120-124. DOI: 10.1136/thx.52.2.120IF: 9.0 Q1 .
[59] Roger N, Barberà JA, Farré R, et al. Effect of nitric oxide inhalation on respiratory system resistance in chronic obstructive pulmonary disease[J]. Eur Respir J, 1996, 9(2):190-195. DOI: 10.1183/09031936.96.09020190IF: 16.6 Q1 .
[60] Vonbank K, Ziesche R, Higenbottam TW, et al. Controlled prospective randomised trial on the effects on pulmonary haemodynamics of the ambulatory long term use of nitric oxide and oxygen in patients with severe COPD[J]. Thorax, 2003, 58(4):289-293. DOI: 10.1136/thorax.58.4.289IF: 9.0 Q1 .
[61] Gladwin MT, Kato GJ, Weiner D, et al. Nitric oxide for inhalation in the acute treatment of sickle cell pain crisis: a randomized controlled trial[J]. JAMA, 2011, 305(9):893-902. DOI: 10.1001/jama.2011.235IF: 63.1 Q1 .
[62] Maitre B, Djibre M, Katsahian S, et al. Inhaled nitric oxide for acute chest syndrome in adult sickle cell patients: a randomized controlled study[J]. Intensive Care Med, 2015, 41(12):2121-2129. DOI: 10.1007/s00134-015-4060-2IF: 27.1 Q1.
[63] Patel JK, Schoenfeld E, Hou W, et al. Inhaled nitric oxide in adults with in-hospital cardiac arrest: A feasibility study[J]. Nitric Oxide, 2021, 115:30-33.DOI:10.1016/j.niox.2021.07.001IF:3.2 Q2.
[64] Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension[J]. Eur Respir J, 2023, 61(1):2200879. DOI: 10.1183/13993003.00879-2022IF: 16.6 Q1 .
[65] 中华医学会呼吸病学分会肺栓塞与肺血管病学组,中国医师协会呼吸医师分会肺栓塞与肺血管病工作委员会,全国肺栓塞与肺血管病防治协作组,等. 中国肺动脉高压诊断与治疗指南(2021版)[J]. 中华医学杂志, 2021, 101(1):11-51.DOI:10.3760/cma.j.cn112137-20201008-02778.
[66] Abman SH, Hansmann G, Archer SL, et al. Pediatric pulmonary hypertension: guidelines from the American Heart Association and American Thoracic Society[J]. Circulation, 2015, 132(21):2037-2099. DOI: 10.1161/CIR.0000000000000329IF: 35.5 Q1 .
[67] Rosenzweig EB, Abman SH, Adatia I, et al. Paediatric pulmonary arterial hypertension: updates on definition, classification, diagnostics and management[J]. Eur Respir J, 2019, 53(1):1801916. DOI: 10.1183/13993003.01916-2018IF: 16.6 Q1 .
[68] Bischoff AR, Giesinger RE, Neary E, et al. Clinical and echocardiography predictors of response to inhaled nitric oxide in hypoxemic term and near-term neonates[J]. Pediatr Pulmonol, 2021, 56(5):982-991. DOI: 10.1002/ppul.25252IF: 2.7 Q1 .
[69] Ahmed MS, Giesinger RE, Ibrahim M, et al. Clinical and echocardiography predictors of response to inhaled nitric oxide in hypoxic preterm neonates[J]. J Paediatr Child Health, 2019, 55(7):753-761. DOI: 10.1111/jpc.14286IF: 1.6 Q2 .
[70] Plazak W, Gryga K, Sznajd J, et al. Reactivity of pulmonary circulation and right ventricle function to inhaled nitric oxide in systemic sclerosis patients[J]. Clin Rheumatol, 2012, 31(1):99-104. DOI: 10.1007/s10067-011-1792-4IF: 2.9 Q2 .
[71] Al Omar S, Salama H, Al Hail M, et al. Effect of early adjunctive use of oral sildenafil and inhaled nitric oxide on the outcome of pulmonary hypertension in newborn infants. A feasibility study[J]. J Neonatal Perinatal Med, 2016, 9(3):251-259. DOI: 10.3233/NPM-16161.
[72] Day RW, Allen EM, Witte MK. A randomized, controlled study of the 1-hour and 24-hour effects of inhaled nitric oxide therapy in children with acute hypoxemic respiratory failure[J]. Chest, 1997, 112(5):1324-1331. DOI: 10.1378/chest.112.5.1324IF: 9.5 Q1 .
[73] Gerlach H, Keh D, Semmerow A, et al. Dose-response characteristics during long-term inhalation of nitric oxide in patients with severe acute respiratory distress syndrome: a prospective, randomized, controlled study[J]. Am J Respir Crit Care Med, 2003, 167(7):1008-1015. DOI: 10.1164/rccm.2108121IF: 19.3 Q1 .
[74] Boly TJ, Dagle JM, Klein JM, et al. Response categorization and outcomes in extremely premature infants born at 22-26 weeks gestation that received inhaled nitric oxide for hypoxic respiratory failure[J]. J Perinatol, 2023, 43(3):324-331. DOI: 10.1038/s41372-022-01582-4IF: 2.4 Q1 .
[75] Kinsella JP, Truog WE, Walsh WF, et al. Randomized, multicenter trial of inhaled nitric oxide and high-frequency oscillatory ventilation in severe, persistent pulmonary hypertension of the newborn[J]. J Pediatr, 1997, 131(1 Pt 1):55-62. DOI: 10.1016/s0022-3476(97)70124-0IF: 3.9 Q1 .
[76] Rolley L, Bandeshe H, Boots RJ. 'Safe' methaemoglobin concentrations are a mortality risk factor in patients receiving inhaled nitric oxide[J]. Anaesth Intensive Care, 2011, 39(5):919-925. DOI: 10.1177/0310057X1103900519IF: 1.1 Q3 .
[77] Pearl JM, Nelson DP, Raake JL, et al. Inhaled nitric oxide increases endothelin-1 levels: a potential cause of rebound pulmonary hypertension[J]. Crit Care Med, 2002, 30(1):89-93. DOI: 10.1097/00003246-200201000-00014IF: 7.7 Q1 .
[78] Christenson J, Lavoie A, O'Connor M, et al. The incidence and pathogenesis of cardiopulmonary deterioration after abrupt withdrawal of inhaled nitric oxide[J]. Am J Respir Crit Care Med, 2000, 161(5):1443-1449. DOI: 10.1164/ajrccm.161.5.9806138IF: 19.3 Q1 .
[79] Atz AM, Wessel DL. Sildenafil ameliorates effects of inhaled nitric oxide withdrawal[J]. Anesthesiology, 1999, 91(1):307-310. DOI: 10.1097/00000542-199907000-00041IF: 9.1 Q1 .
[80] Weinberger B, Laskin DL, Heck DE, et al. The toxicology of inhaled nitric oxide[J]. Toxicol Sci, 2001, 59(1):5-16. DOI: 10.1093/toxsci/59.1.5IF: 3.4 Q2 .
[81] Narula P, Xu J, Kazzaz JA, et al. Synergistic cytotoxicity from nitric oxide and hyperoxia in cultured lung cells[J]. Am J Physiol, 1998, 274(3):L411-416. DOI: 10.1152/ajplung.1998.274.3.L411IF: 3.6 Q1 .
[82] Mizutani T, Layon AJ. Clinical applications of nitric oxide[J]. Chest, 1996, 110(2):506-524. DOI: 10.1378/chest.110.2.506IF: 9.5 Q1 .
[83] Gaston B, Drazen JM, Loscalzo J, et al. The biology of nitrogen oxides in the airways[J]. Am J Respir Crit Care Med, 1994, 149(2 Pt 1):538-551. DOI: 10.1164/ajrccm.149.2.7508323IF: 19.3 Q1 .
[84] 钱爱民, 朱雯, 杨洋, 等. 经一氧化氮吸入治疗的新生儿持续肺动脉高压患儿死亡的早期影响因素分析[J]. 中国当代儿科杂志, 2022, 24(5):507-513. DOI: 10.7499/j.issn.1008-8830.2111191.
[85] Beghetti M, Sparling C, Cox PN, et al. Inhaled NO inhibits platelet aggregation and elevates plasma but not intraplatelet cGMP in healthy human volunteers[J]. Am J Physiol Heart Circ Physiol, 2003, 285(2):H637-642. DOI: 10.1152/ajpheart.00622.2002IF: 4.1 Q1 .
[86] Ruan SY, Huang TM, Wu HY, et al. Inhaled nitric oxide therapy and risk of renal dysfunction: a systematic review and meta-analysis of randomized trials[J]. Crit Care, 2015, 19(1):137. DOI: 10.1186/s13054-015-0880-2IF: 8.8 Q1 .
[87] Arroyo PL, Hatch-Pigott V, Mower HF, et al. Mutagenicity of nitric oxide and its inhibition by antioxidants[J]. Mutat Res, 1992, 281(3):193-202. DOI: 10.1016/0165-7992(92)90008-6.
[88] Isomura K, Chikahira M, Teranishi K, et al. Induction of mutations and chromosome aberrations in lung cells following in vivo exposure of rats to nitrogen oxides[J]. Mutat Res, 1984, 136(2):119-125. DOI: 10.1016/0165-1218(84)90153-8.
[89] Nguyen T, Brunson D, Crespi CL, et al. DNA damage and mutation in human cells exposed to nitric oxide in vitro[J]. Proc Natl Acad Sci U S A, 1992, 89(7):3030-3034. DOI: 10.1073/pnas.89.7.3030IF: 9.4 Q1 .
[90] Wink DA, Kasprzak KS, Maragos CM, et al. DNA deaminating ability and genotoxicity of nitric oxide and its progenitors[J]. Science, 1991, 254(5034):1001-1003. DOI: 10.1126/science.1948068IF: 44.7 Q1 .
[91] U.S. Department of Health and Human Services Food and Drug Administration Center for Devices and Radiological Health. Guidance for industry and for FDA reviewers-Guidance document for premarket notification submissions for nitric oxide delivery apparatus, nitric oxide analyzer and nitrogen dioxide analyzer[EB/OL]. 2000[2019-05-05]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/guidance-document-premarket-notification- submissions-nitric-oxide-delivery-apparatus-nitric-oxide.
[92] Hesterberg TW, Bunn WB, McClellan RO, et al. Critical review of the human data on short-term nitrogen dioxide (NO2) exposures: evidence for NO2 no-effect levels[J]. Crit Rev Toxicol, 2009, 39(9):743-781. DOI: 10.3109/10408440903294945IF: 5.7 Q1 .
[93] Tang SF, Miller OI. Inhaled nitric oxide during emergency neonatal transportation[J]. J Paediatr Child Health, 1996, 32(6):539-541. DOI: 10.1111/j.1440-1754.1996.tb00970.xIF: 1.6 Q2 .
[94] Troncoso R Jr, Garfinkel EM, Kaul K, et al. Safety of nurse-managed inhaled nitric oxide during critical care interfacility transport[J]. J Intensive Care Med, 2023, 38(8):768-772. DOI: 10.1177/08850666231178710IF: 3.0 Q2 .
[95] Montgomery FJ, Berssenbrugge AD. Inhaled nitric oxide delivery and monitoring[J]. J Clin Monit Comput, 1999, 15(5):325-335. DOI: 10.1023/a:1009920724708IF: 2.0 Q2 .
[96] Aly H, Sahni R, Wung JT. Weaning strategy with inhaled nitric oxide treatment in persistent pulmonary hypertension of the newborn[J]. Arch Dis Child Fetal Neonatal Ed, 1997, 76(2):F118-122. DOI: 10.1136/fn.76.2.f118IF: 3.9 Q1 .
[97] Namachivayam P, Theilen U, Butt WW, et al. Sildenafil prevents rebound pulmonary hypertension after withdrawal of nitric oxide in children[J]. Am J Respir Crit Care Med, 2006, 174(9):1042-1047. DOI: 10.1164/rccm.200605-694OCIF: 19.3 Q1 .
声明:
转载的文章仅用于学术信息传播和学习,版权归原作者和原出处所有,如有侵权请联系删除。
 后可发表评论
后可发表评论

相关推荐
1
雾化吸入疗法在呼吸疾病中的应用专家共识
4.5w
2
【规范与指南】人感染H7N9禽流感诊疗方案(2017年第一版)
3.3w
3
【最新】新型冠状病毒肺炎诊疗方案-试行第五版
2.5w
4
【指南与共识】新型冠状病毒(2019-nCoV)感染的肺炎诊疗快速建议指南 (标准版)
2.1w
5
重磅 | 急性呼吸窘迫综合征患者机械通气指南(试行)(一)
1.6w
6
2015新版GOLD COPD指南摘译和解读
1.4w
7
【指南共识】2014年欧洲危重病医学会休克及血流动力学监测共识
1.3w
8
MRSA肺炎:亚太专家共识
1.2w
9
儿童肺炎支原体肺炎诊疗指南(2023年版)
1.1w
10
2019特发性肺纤维化急性加重诊断和治疗中国专家共识
1.1w



友情链接
联系我们
 公众号
公众号
 客服微信
客服微信