登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:王凯
单位:南方医科大学珠江医院呼吸与危重症医学科
ARDS的病理生理特征主要表现为:
(1)病变不均一:如图1所示,上部分属于过度膨胀区(干肺),中间部分为可复张区(湿肺),下部分为实变区(塌陷肺)。
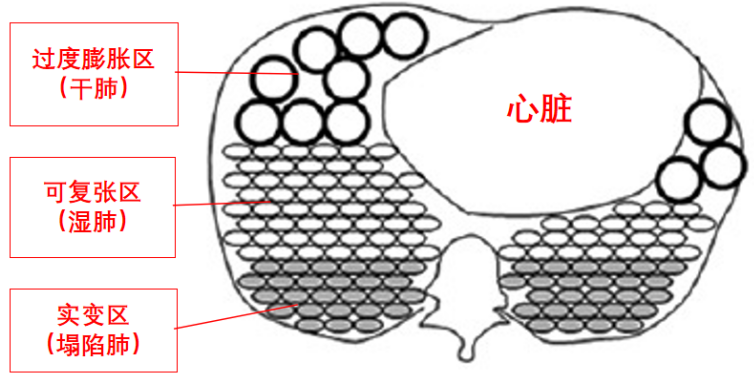

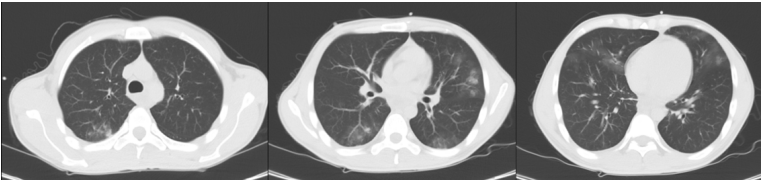

ARDS患者通常会出现通气血流比例下降,即使机械通气也不一定能够改善这种情况。ARDS患者肺实变区(塌陷区)无法进行气体交换,所以静脉血流经此实变区后仍然是静脉血。但在膨胀区,由于送入的气体太多,肺泡过度膨胀使肺泡间血管受压,增加了血管阻力,造成肺动脉升高,进而导致新的通气血流比例失调。由此可见,如果呼吸机使用不当,不仅无法改善病情,甚至还可能导致病变加重。
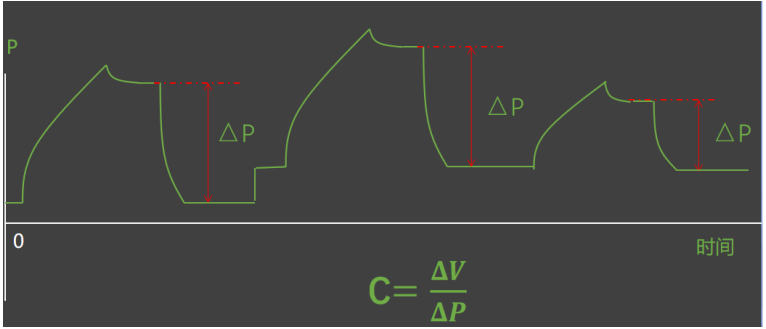
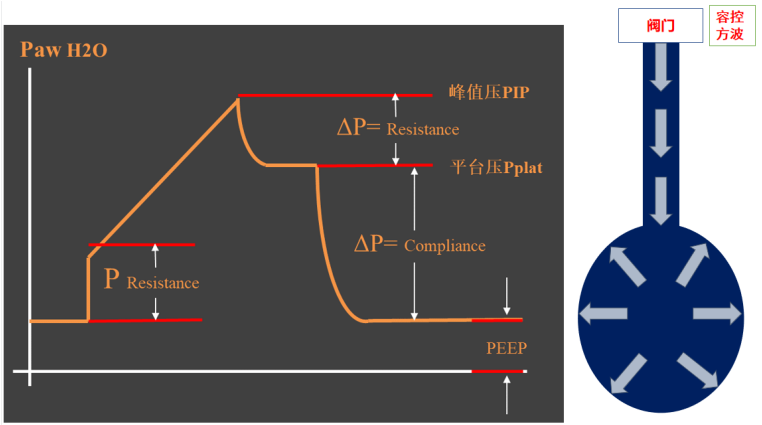
ECMO支持下的超级肺保护通气策略就是:①小潮气量:<6 ml/kg IBW;②限制平台压:≤20~25 cmH2O;③限制驱动压:≤15 cmH2O;④限制跨肺压:吸气末跨肺压<15 cmH2O;⑤保持肺泡开放:最佳PEEP;⑥呼吸频率:5~10 bpm(pH≥7.25);⑦俯卧位通气和肺复张。

图11 患者入院后胸片

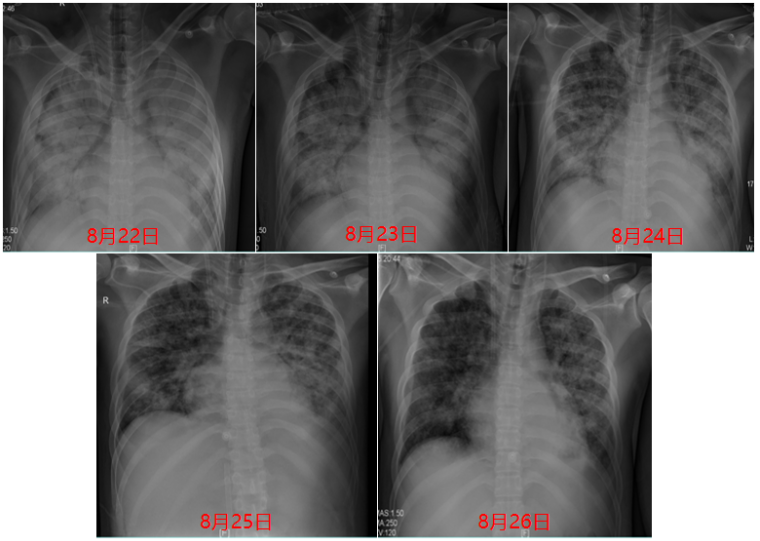
撤离ECMO后复查胸部及颅脑CT提示:肺部病变较前明显吸收,心脏超声提示心功能明显改善。ECMO撤机后的呼吸机参数:FiO2 40%,压力支持16 cmH2O,监测潮气量480 ml左右,顺应性30 ml/cmH2O左右。
参考文献
作者介绍
王凯
本文根据“PCCM呼吸治疗大讲堂”第14期视频整理,感谢王凯医师予以审核修改。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信