
患者男性,53 岁,因“咳嗽、发热半个月”收治入院。患者入院半个月前无明显诱因开始出现咳嗽,咳少量黄白色黏痰,间断有黄脓痰,伴畏寒、发热,体温最高39℃,自觉乏力,咳嗽时左前胸部隐痛不适,查胸部CT示两肺炎症(图1)。在当地住院治疗,予“头孢替安+左氧氟沙星”抗感染4 d无效,改予“头孢他啶+莫西沙星”抗感染5 d,仍无效。
复查胸部CT示肺部病灶进展,右肺病灶增多(图2)。再予“亚胺培南西司他丁+万古霉素”抗感染治疗,效果仍不佳,患者仍反复高热,转来我院。既往有糖尿病病史,口服格列齐特降糖治疗,血糖控制不佳,在当地医院住院期间,改予诺和灵R+诺和灵N降糖治疗。T 36.7℃,P 78次/min,R 20次/min,BP 129/70 mmHg,SpO2 98%。两肺呼吸音粗,未闻及干/湿啰音,心律齐;双下肢胫前区皮疹,脚癣明显。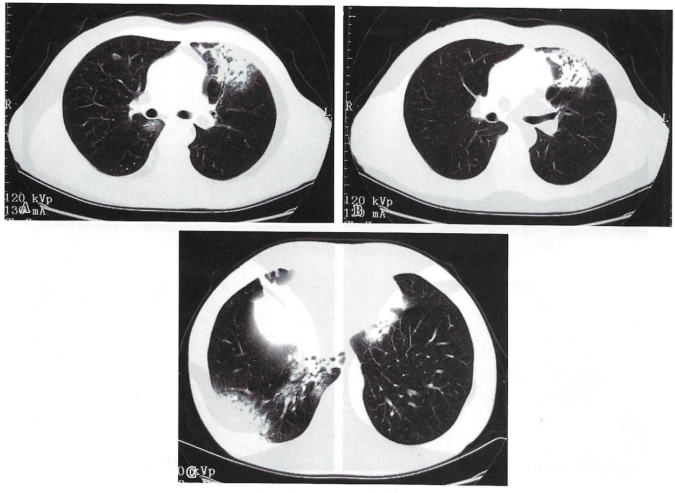

患者入院后查血常规:WBC 7.8×109/L,NEU% 73%,Hb 116 g/L,PLT 185×109/L,CRP 62.67 mg/L。内毒素测定24.07 pg/ml,考虑肺部革兰氏阴性菌感染可能性大,予哌拉西林他唑巴坦4.5 g q8h抗感染,患者仍反复高热,体温最高39℃左右。肺功能检查:轻度限制性通气功能减退,肺弥散功能轻度降低,残/总百分比正常,肺小气道阻力正常。气管镜检查:镜下见左上叶前段及右下叶基底段黏膜苍白、水肿,管腔内见黏痰附着。支气管肺泡灌洗液细菌培养、真菌培养均阴性。血自身抗体及血肿瘤指标均正常。G试验78.58 pg/ml,GM试验0.083 μg/L,血糖10.4~22.6 mmol/L,考虑合并真菌感染可能,加用伏立康唑经验性抗真菌治疗1周。患者仍反复发热,体温最高38~39℃,午后低热为主,红细胞沉降率(ESR)104 mm/h,血结核抗体均阴性,结核感染T细胞试验阴性。结核科会诊,考虑合并结核可能,停用伏立康唑,予异烟肼、乙胺丁醇、利福平经验性抗结核治疗5 d,体温无明显好转,停经验性抗结核治疗。复查血常规:WBC 8.2×109/L,NEU% 80%,Hb 102 g/L,PLT 156×109/L,CRP 107.69 mg/L,考虑感染未得到有效控制,停哌拉西林他唑巴坦,改予美罗培南+万古霉素加强抗感染治疗。入院3周后(美罗培南+万古霉素使用1周后)患者症状较前加重,一般情况差,反复高热,体温39℃左右,呼吸困难加重,食欲缺乏、消瘦、乏力,两肺底出现少许湿啰音。血气分析(吸氧浓度为33%):pH 7.47,PaCO2 31 mmHg,PaO2 57 mmHg,HCO3- 27 mmol/L。复查胸部CT:两肺病灶较前明显增多,部分病灶吸收,但出现更多新鲜渗出病灶(图3)。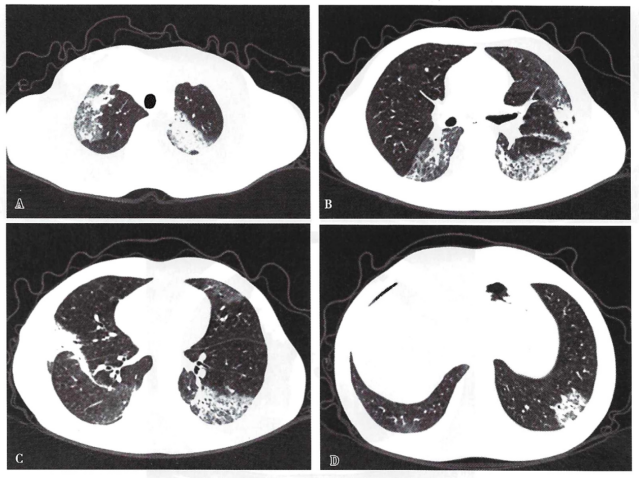
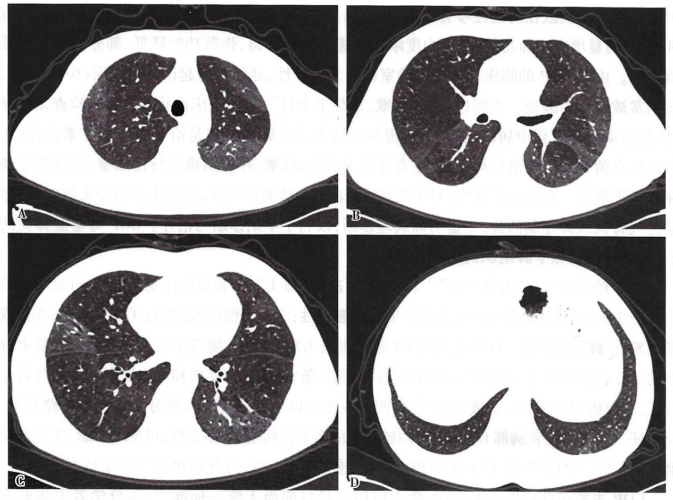
行CT引导下经皮肺活检,活检病理示:肺泡上皮轻度增生,肺间隔增宽伴少量炎细胞浸润,肺间隔纤维组织增生,见Masson小体形成,形态学符合机化性肺炎(OP)改变。特殊染色结果:Masson(+),VG(+)。确诊为隐源性机化性肺炎(COP)。停用万古霉素、美罗培南,予泼尼松30 mg qd治疗,3 d后患者体温恢复正常,呼吸困难改善,1周后复查胸部CT见肺部病灶有所吸收(图4),5周后复查胸部CT可见肺部病灶明显吸收(图5)。患者出院后泼尼松逐渐减量,8个月后停止使用。随访未再复发。

三、讨论
COP是一组原因不明的少见疾病。其相应的临床-放射-病理学定义是指没有明确的致病原(如感染)或其他临床伴随疾病(如结缔组织疾病等)的情况下出现的OP。OP是肺小血管通透性增加,血浆蛋白在肺泡内渗出后造成肺泡损伤后的病理表现,具有非特异性。其病理特点为:病变呈斑片状分布,病变中央为小气道,肺泡内、肺泡管内见疏松的胶原样结缔组织增生,形成Masson小体,可伴或不伴终末和呼吸性细支气管内结缔组织肉芽栓的形成,肺泡壁和肺泡间隔有以单核细胞为主的细胞浸润,肺结构往往正常,镜下病变均匀一致。上述病理表现亦可见于过敏性肺炎、韦格纳肉芽肿、慢性嗜酸细胞性肺炎、细支气管肺泡癌或肺梗死病灶的外周部等。因此,COP的临床诊断必须在病理表现的基础上,结合临床、影像和实验室检查来判断。本例患者肺穿刺病理提示OP,结合病史、胸部影像学表现及自身抗体和免疫学等实验室检查结果,排除其他因素,最终诊断为COP。COP发病年龄在50~60岁,无性别差异,与吸烟无关。多为亚急性起病,表现为发热,刺激性咳嗽,活动后气短,程度多数较轻,酷似感染,部分患者可伴有乏力、食欲减低和体重下降等全身症状。部分患者有流感样前驱症状。上述临床症状在数周内进展。肺部听诊可正常或可闻及散在的湿啰音。血常规:WBC总数正常,NEU可轻度增高。ESR和CRP明显增高。肺功能检查:轻至中度限制性通气功能障碍,弥散功能降低,部分病例出现低氧血症。由于COP的临床表现及实验室检查无特异性,通常会延误诊断(6~13周),初期常被诊断为肺炎。本例患者因“咳嗽、发热半个月”入院,临床症状及实验室检查均无特异性,抗感染治疗过程中病情逐渐加重,极易误诊为重症肺炎。但给予多种抗生素治疗,经验性抗真菌及抗结核治疗均无效,患者体温无下降,咳嗽、呼吸困难进行性加重,最终依靠肺穿刺病理确诊。在临床工作中,对于胸部CT表现为肺炎样病灶,而抗生素治疗无效时,应尽早行气管镜或肺穿刺活检,尽量明确病理诊断,以利于早期诊断与治疗。COP与重症肺炎的鉴别最终仍依赖于肺组织活检。COP的影像学有“五多一少”的特点:① 多态性(肺实变及磨玻璃样变最常见,可见小结节影或肿块影,网格状及条索状改变较少见);② 多发性;③ 多变性(游走性);④ 多复发性;⑤ 多双肺受累;⑥蜂窝肺少见。COP的胸部CT常见表现为双肺外带、胸膜下或沿支气管血管束分布的斑片状实变影、磨玻璃影、结节影或肿块影、条索影,实变影和肿块影中可见支气管充气征,少数病例存在胸腔积液,往往存在两种或两种以上改变,部分患者存在碎石路征及反晕征。本例患者胸部CT表现为两肺受累的多发性病变,呈多态性,可见斑片影、实变影及磨玻璃影等,病灶沿胸膜下分布,有游走性,抗感染治疗无效,符合COP的影像学特点。COP主要以糖皮质激素进行治疗,激素应用剂量目前尚无统一标准,部分学者主张低剂量、短疗程,部分主张高剂量、长疗程。目前多建议疗程为1年,因停药过早,复发的可能性增加。病情较重者,初期可予甲泼尼龙短期静脉注射,初期治疗奏效后激素用量逐渐减少,最快48 h临床症状改善,肺部阴影在1~2周后开始吸收,治疗4周后基本消散。有文献报道大环内酯类抗生素治疗COP有效,对激素治疗抵抗者,利妥昔单抗有良好的疗效。大部分COP患者在激素治疗后,临床症状和胸部影像表现能够迅速改善,预后良好,部分患者出现复发,但复发并不增加病死率,激素减量过快、疗程过短或肺部多发性阴影易复发,复发率为13%~58%。复发患者再次予激素治疗依然有效。死亡病例多为治疗效果不佳的晚期诊断病例。少数COP病例暴发起病或病情急剧进展,肺部弥漫性浸润影,严重低氧血症,符合急性肺损伤或ARDS的诊断标准,部分患者需无创或气管插管机械通气,此类病例如不能早期明确诊断,及时使用激素,预后较差,甚至死亡。故早期诊断、早期合理使用激素治疗、防治激素并发症是影响预后的重要因素。
四、总结
从该病例我们可以看出,COP临床表现及影像学表现与感染性疾病类似,实验室检查无特异性,通常会被诊断为肺炎,在抗生素治疗后病情进行性加重,用普通细菌感染无法解释时,方考虑本病的可能。当患者出现下列表现时可高度提示COP:①流感样症状,亚急性起病,临床有呼吸困难、持续性干咳、发热症状,体重减轻;②肺部有爆裂音,无杵状指;③胸部X线片呈游走性斑片状影(或呈弥漫性网状、结节状影);④多种抗生素治疗时病情进行性加重,并除外肺结核、支原体和真菌等肺部感染;⑤患者一般状况好而肺部影像表现相对较重,病程2~3个月病灶不吸收,以“肺炎延迟吸收”也无法解释;⑥患者既往健康,无大量使用激素、免疫抑制剂的病史或免疫功能受损,病程初期胸部X线片即表现为多段多叶肺部阴影,也无法用非典型病原体所致社区获得性肺炎(CAP)解释;⑦肾上腺皮质激素治疗效果显著。对于重症患者,早期诊断和治疗是挽救生命的关键。当临床表现及影像学提示COP时,仍推荐通过组织病理学确定COP的诊断,并需注意识别和排除各种继发性OP。
五、专家点评
当胸部CT上出现“肺炎样实变影”,OP与CAP常常是容易混淆的两类疾病。本病例病程初期胸部CT表现为多发“肺炎样实变影”,临床上有发热、咳嗽等症状,很容易按照CAP进行抗感染为主的治疗,本病例病程初期即分别针对普通细菌、真菌及结核进行了治疗,病情进展加重,通过肺活检病理诊断OP,糖皮质激素治疗后缓解,最终诊断COP。本病例诊疗过程有几点值得重视:① 本病例初次胸部CT多发实变影中部分可见空气支气管征,抗感染治疗后复查胸部CT显示病灶有增多,而且实变影中空气支气管征明显增多,影像学提示有OP组织修复后收缩倾向,“过度的”空气支气管征是OP的非常有意义的影像学特征之一。因此,本病例患者在诊治过程中,如果能够及时抓住影像学上“非感染”的证据,应该是在第一次复查CT后积极寻找肺活检机会,获取组织病理学证据。② OP患者以多发实变影为表现者,一般患者肺部能听诊发现典型的“爆裂音”,这也提醒临床医师早期进行肺活检病理诊断,而不是进一步延长原先抗感染方案或频繁更换抗感染方案。③ 患者第三、四次胸部CT显示实变影呈“游走样”特征也是OP的影像学重要特征。④ 患者恢复期最后一次胸部CT显示先前的实变病灶变为磨玻璃影,这也是OP恢复期的一种“吸收”方式,对于回顾性诊断有帮助。[1] 李惠萍, 范峰, 李秋红, 等. 肺活检证实隐源性机化性肺炎25例临床诊治体会[J]. 中华结核和呼吸杂志,2007,30(4):259-264.
[2] Arakawa H, Kurihara Y, Niimi H, et al. Bronchiolitis obliterans with organizing pneumonia versus chronic eosirophilic pneumonia: high resolution CT findings in 81 patients[J]. Am J Roentgenol, 2001, 176(4):1053-1058.
[3] Cordier J F. Cryptogenic organizing pneumonia[J]. Eur Respir J, 2006, 28(2):422-446.
[4] Zhao X, Zhang L, Wang Z, et al. Reversed halo sign:presents in different pulmonary diseases[J]. PLoS One, 2015, 10(6):e0128153.
[5] Cordier J F. Cryptogenic organizing pneumonia[J]. Clin Chest Med, 2004, 25(4):727-738.
[6] Epler G R. Bronchiolitis obliterans organizing pneumonia[J]. Arch Intern Med, 2001, 161(2):158-164.
[7] Ding O L, Lv D, Wang B J, et al. Macrolide therapy in cryptogenic organizing pneumonia;A case report and liter-ature review[J]. Exp Ther Med, 2015, 9(3):829-834.
[8] Shitenberg D, Fruchter O, Fridel L, et al. Successful rituximab therapy in steroid-resistant, cryptogenicorganizing pneumonia: a case series[J]. Respiration, 2015, 90(2):155-159.
[9] Oymak F S, Demirbas H M, Mavili E, et al. Bronchiolitis obliterans organizing pneumonia, Clinical and roentgenological features in 26 cases[J]. Respiration, 2005, 72(3):254-262.
[10] Jareno E J, Zamora C E, Chillon Martin M J, et al. Bronchiolitis obliterans with idiopathic organizing pneumoniausefulness and yield of diagnostic techniques and procedures in a series of 20 patients[J]. An Med Interna, 2001, 18(2):63-68.
 后可发表评论
后可发表评论




 公众号
公众号
 客服微信
客服微信