登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
单位:华中科技大学同济医学院附属同济医院呼吸与危重症医学科

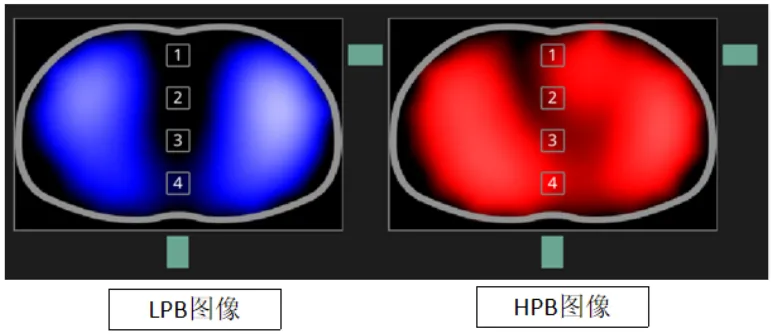
图1 肺的EIT图像

图2 肺不张情况下EIT图像
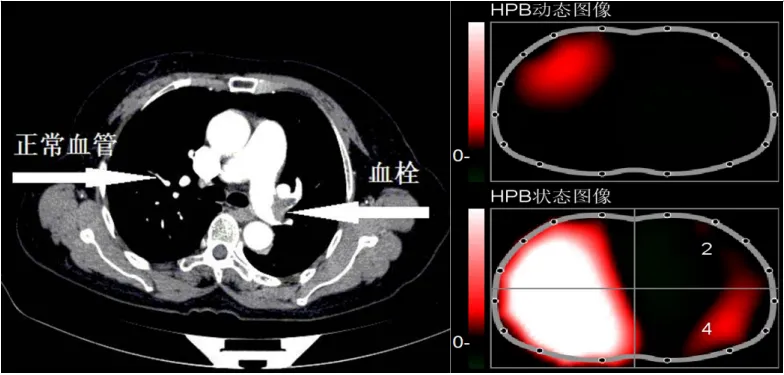
图3 肺部存在血栓情况下EIT图像

以经典的ARDS为例,肺容积小且顺应性差,肺内改变不均一,肺损伤主要表现为容积伤、气压伤、生物伤以及萎陷伤(不张伤)。既往治疗常通过小潮气量通气、滴定最佳PEEP、控制平台压<30 cmH2O、控制驱动压<15 cmH2O等方法来降低肺损伤,或者通过食道压测量跨肺压滴定最佳PEEP。无论哪种方法,提供的都是一种思路,患者肺内情况究竟如何一直无法进行直观的观察。EIT应用的初衷就是希望通过成熟的电学成像技术打开这一盲区,实现个体化呼吸系统管理和精细化肺保护。
随着危重症患者管理的精细化,重症患者的全程肺保护性管理越来越受到重视,人们开始注意到肺损伤本身是一种恶性循环的机制,当损伤发生,肺泡-毛细血管屏障受到破坏,液体渗出,肺水肿加重,气体交换障碍,导致患者低氧,在这样的状态下,患者呼吸驱动加强,跨肺压增大,气体摆动加剧,肺泡受到的剪切伤导致肺损伤进一步加重。因此,如何避免肺损伤成为医学上重要的问题。
EIT在ARDS患者不同病程阶段都有应用,包括通过EIT监测各种呼吸支持治疗的影响、指导个体化通气设置、滴定最佳PEEP、早期发现并发症等(图4)。
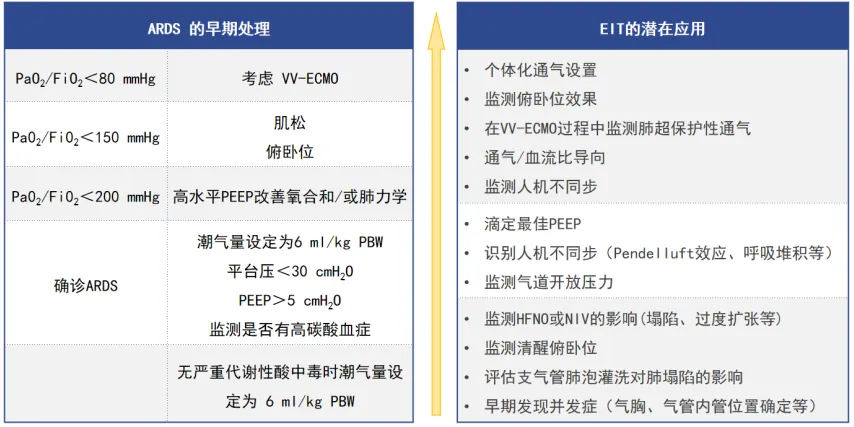
图4 EIT在ARDS中的应用
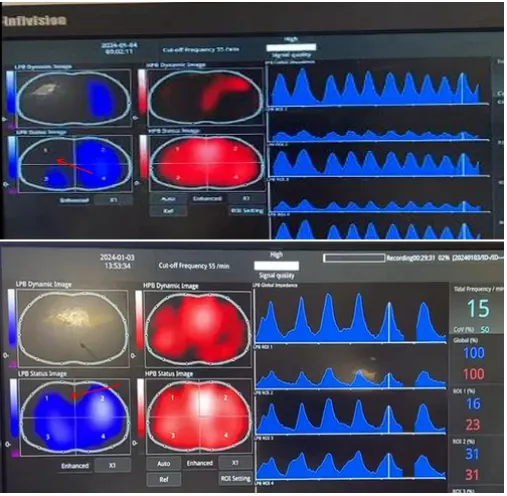
图5 EIT指导呼吸支持方式的选择
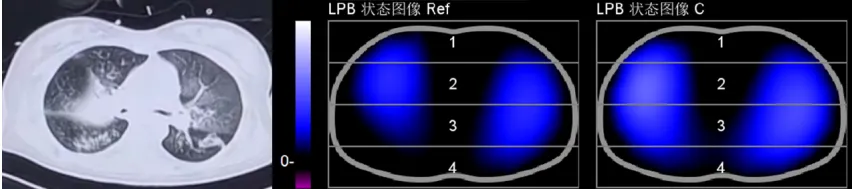
图6 EIT监测俯卧位通气效果
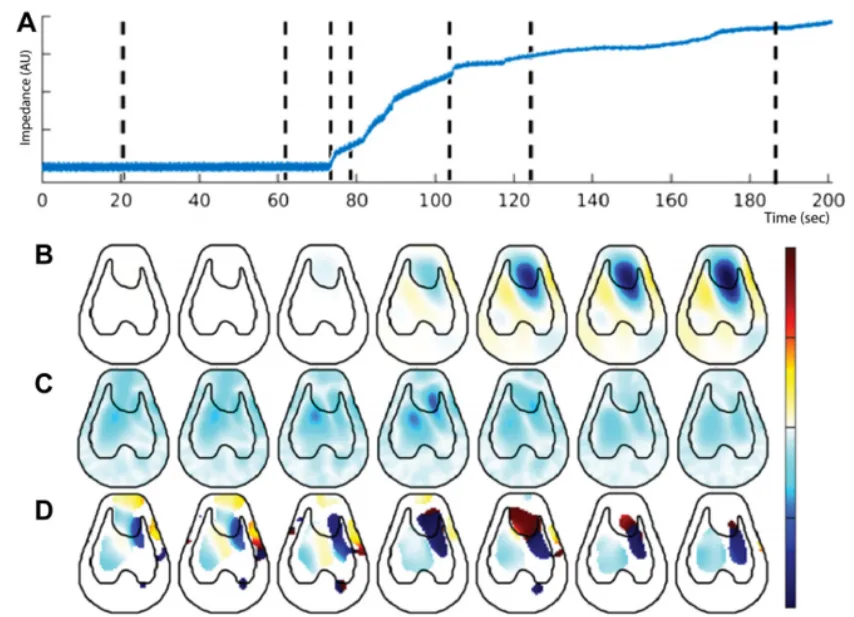
图7 发生单侧气胸时的EIT成像
气胸发生后可以观察到患者右肺腹侧的通气提前,且血流灌注减弱。
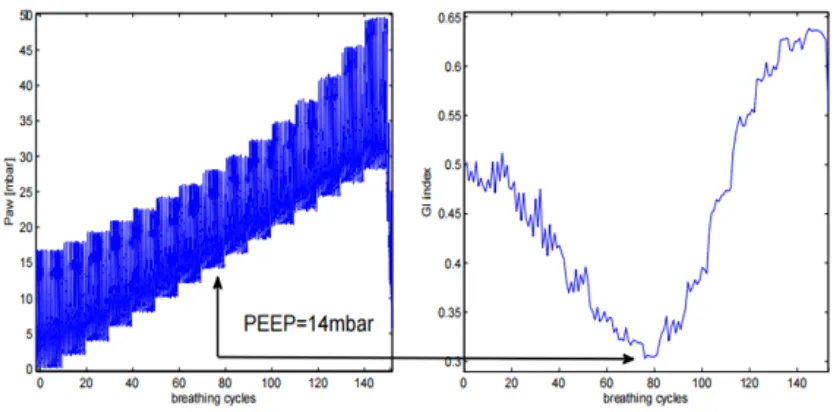
图8 通过最小GI法测得的最佳PEEP
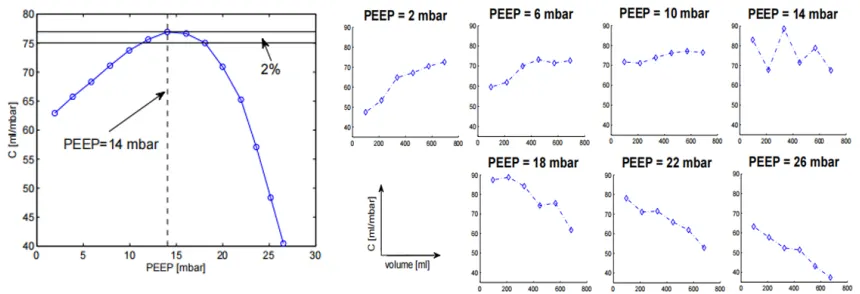
图9 通过最佳顺应性法测得的最佳PEEP
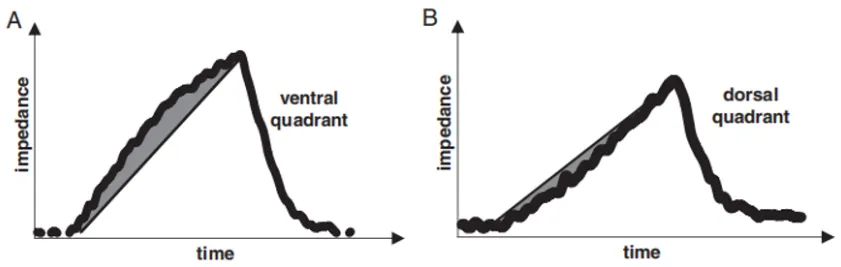
图10 阻抗-时间曲线变化
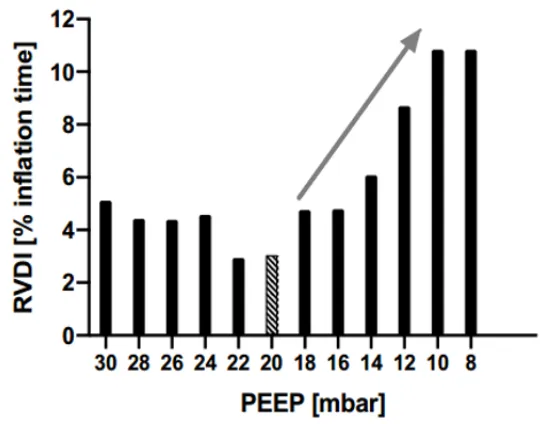
图11 RVDI指导PEEP滴定
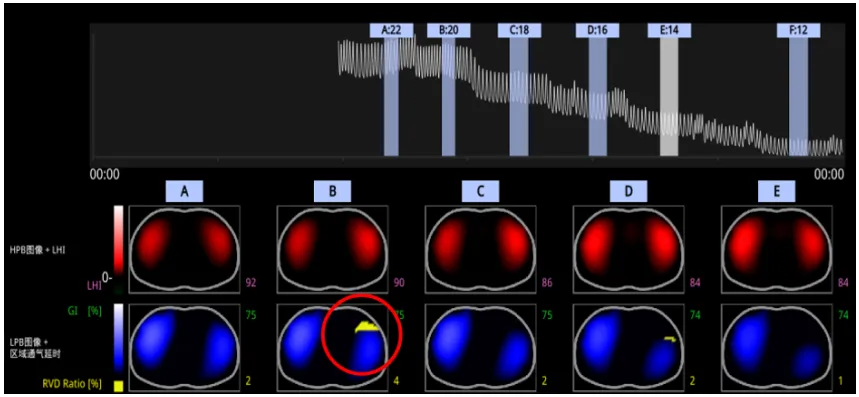
图12 RVD评估参数合理性
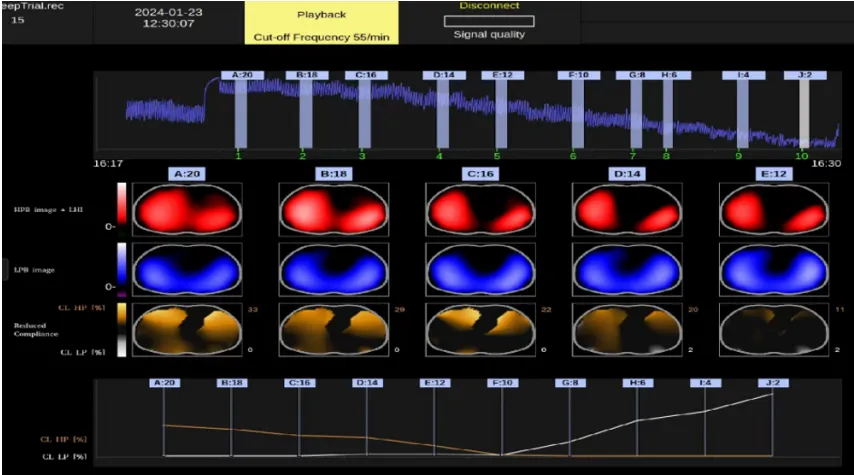
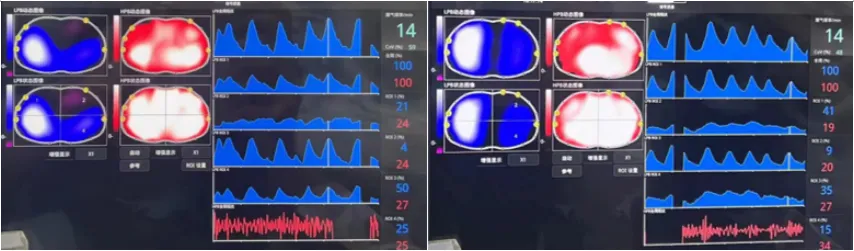
图14 胸部物理治疗前后ARDS患者EIT图像
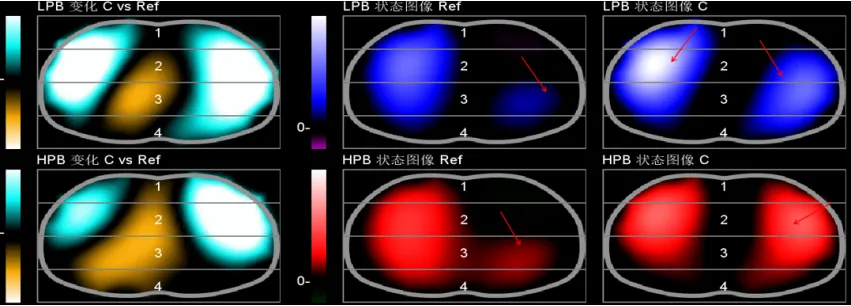
图15 EIT评估肺复张疗效
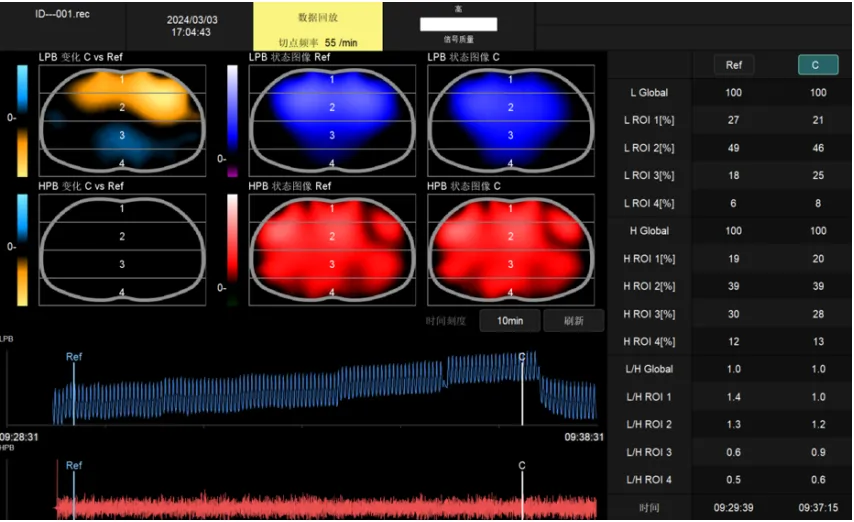
图16 重度ARDS患者EIT图像
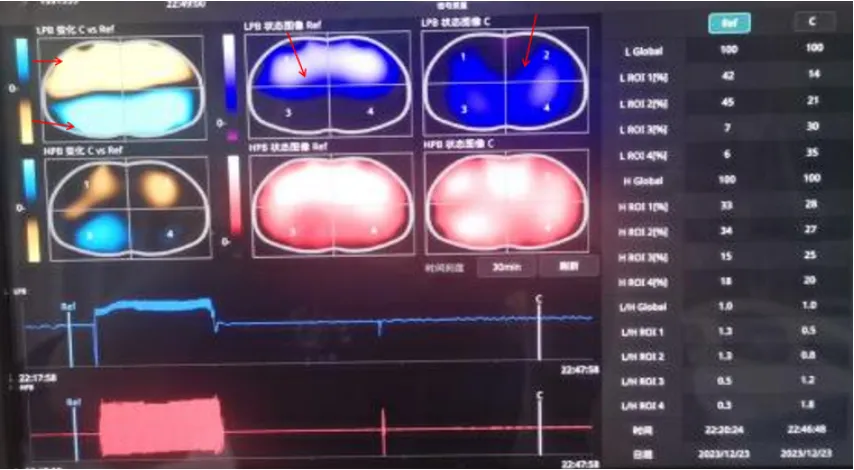
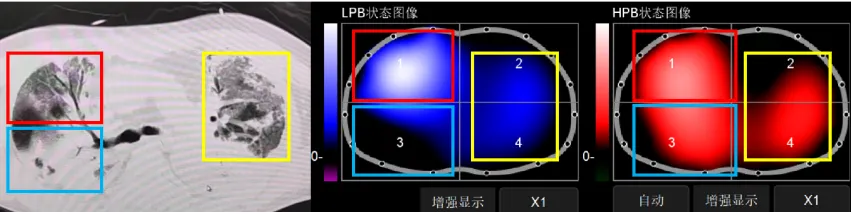
图18 EIT评估通气/血流匹配
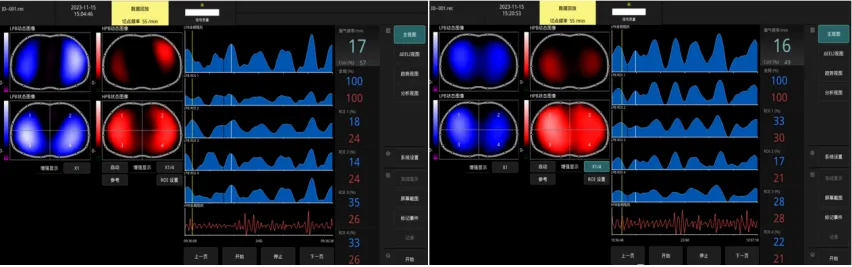
图19 吸入NO治疗前后EIT图像比较
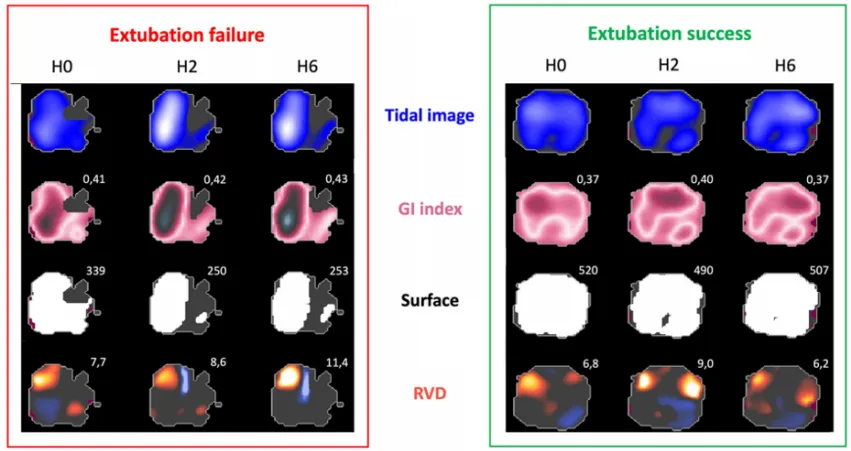
图20 RVD预测撤机拔管结局

EIT在ARDS患者呼吸管理中的临床应用实际上是一种可视化肺保护的临床应用。我们可以通过直观观察EIT图像来了解患者的通气和血流情况,从而更精细化地进行呼吸治疗管理。
参考文献
作者介绍
华中科技大学同济医学院附属同济医院呼吸与危重症医学科科室副主任,教授、主任医师,博士研究生导师;中华医学会呼吸病学分会慢阻肺学组委员,中国慢阻肺联盟常委,中国医师协会呼吸医师分会急危重症工作委员会委员,武汉市医学会呼吸病学分会副主任委员,湖北省医学会呼吸病学分会常务委员,湖北省慢阻肺联盟主任委员,湖北省病理生理学会呼吸专业委员会副主任委员;《中华结核和呼吸杂志》《国际呼吸杂志》通讯编委,《内科急危重症杂志》编委;长期从事呼吸系统疾病基础及临床研究工作,承担重大专项1项,国家自然科学基金面上项目6项,参与973项目2项。在国内外杂志发表中英文论文100余篇,参与获得教育部科技进步奖一等奖。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信