登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:肖冠华,李婧,佟万成
单位:南方医科大学南方医院呼吸与危重症医学科
Round 1:辗转就医,病因未明

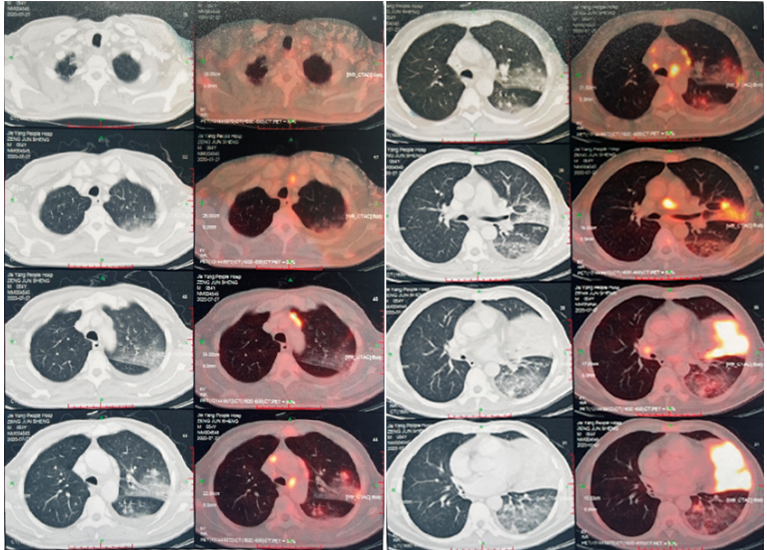
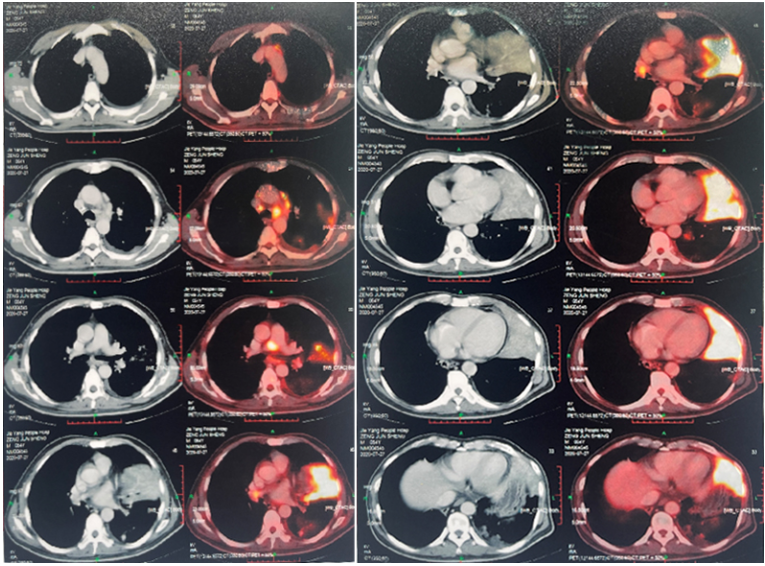
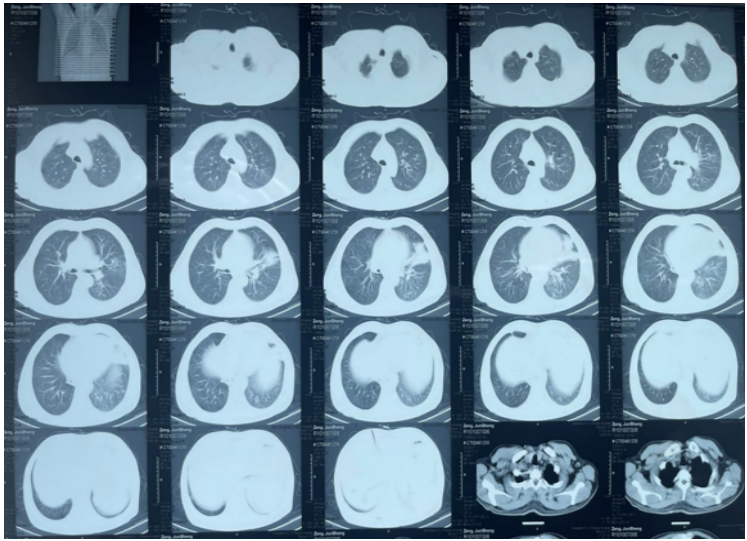
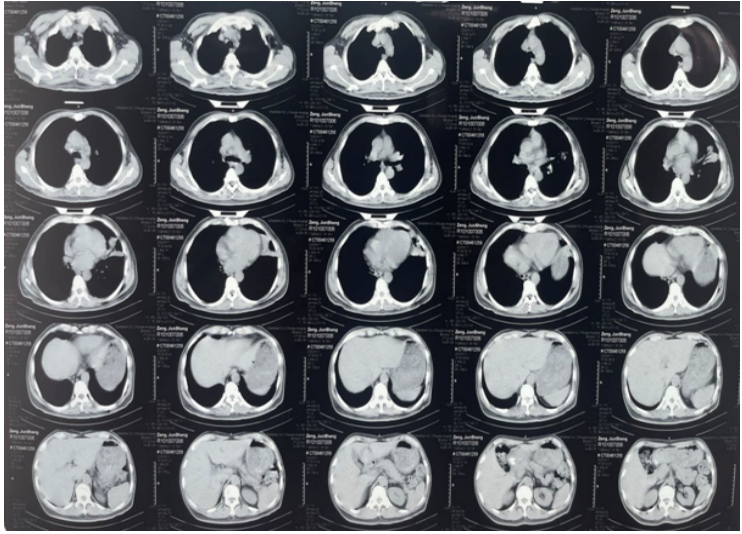
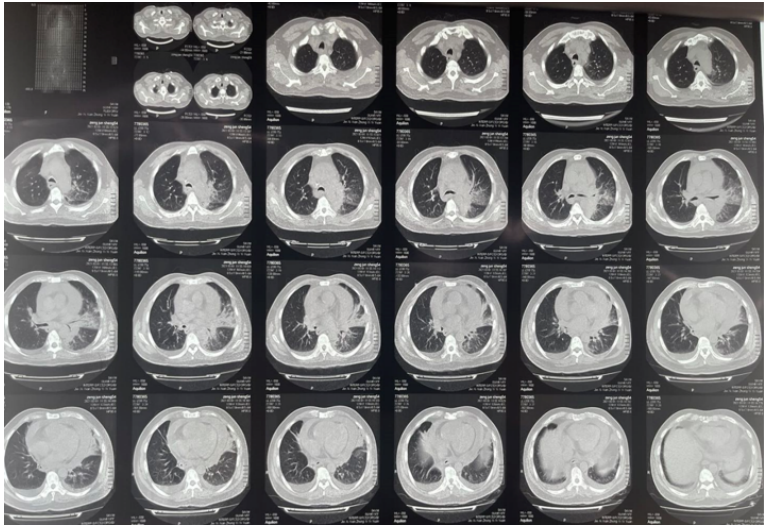
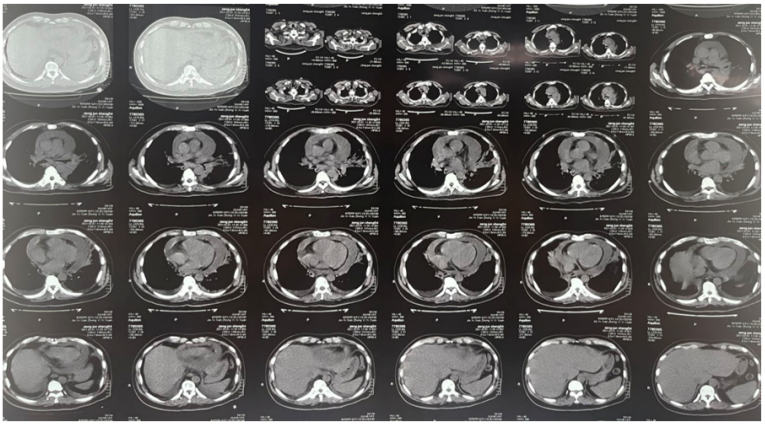
图3 深圳市A医院胸部CT(2021-03-01)
一元论?二元论或多元论?
(1)非感染性疾病:如肺癌、淋巴瘤等恶性疾病,本例患者证据不足。
(2)感染性疾病:①结核感染:涂片、培养、分子生物学检测均阴性,无病理学证据,诊断性治疗1月余仍在进展,考虑可能性不大。②NTM:颈部包块脓液培养见“鸟-胞内分枝杆菌”,需要高度重视!肺内无病原学证据,抗结核治疗中肺部病变急性加重,单纯NTM不好解释。③马尔尼菲篮状菌、奴卡菌等感染:暂无病原学及病理学证据。
诊疗思路:先考虑一元论,后考虑二/多元论;首先倾向为疑难感染性疾病,再次完善多部位病原学+病理学检查。鉴于院外病原学检查均为传统方法,需要借助mNGS予以协助;再次积极排查宿主因素!
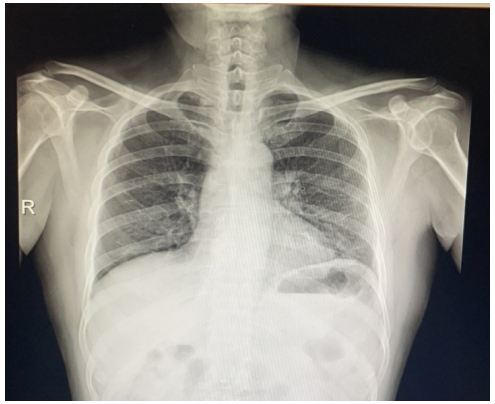
患者入院后胸部CT示:左肺门实变、左下肺渗出,右侧胸腔积液,纵隔多发淋巴结肿大、心包积液(图5)。
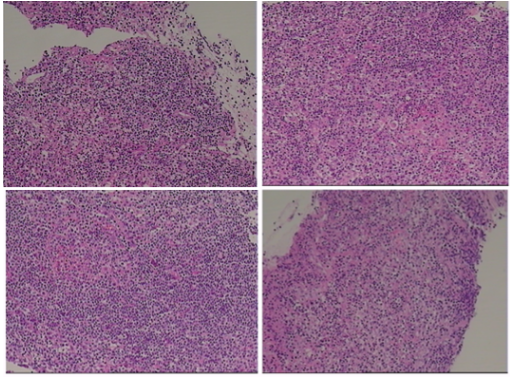
右侧胸水(2021-03-17):CEA阴性,未见癌瘤细胞;气管镜活检(左下背段,2021-03-19):慢性炎伴纤维组织增生,未见明确肉芽肿结构(图6);左锁骨上淋巴结穿刺活检(2021-03-18):纤维脂肪及少许淋巴组织,未见异型细胞浸润(图7)。AAS、PAS、GMS、GRAM均阴性。
入院后予哌拉西林他唑巴坦抗细菌,患者间断发热,Tmax 39.1℃,3月20日锁骨上淋巴结mNGS回报后加用伏立康唑0.2 g VD q12h抗真菌治疗,体温高峰逐渐下降,2021年3月23日后未再发热。
抗凝(2021年3月26日完善CTPA除外肺栓塞)、营养支持、HFNC(入院后氧合指数最低为238 mmHg)、控制血糖等处理。
2021年4月7日超声引导下行右侧颌下原活检处(院外培养到鸟-胞内分枝杆菌)穿刺活检,送检病理:(少许复层鳞状上皮、胶原纤维及横纹肌组织)散在炎性细胞浸润,未见肿瘤性病变;涂片未查到抗酸杆菌、细菌和真菌培养未查到细菌及真菌(送检广州胸科医院行MTB、NTM培养及鉴定)。
患者病情持续好转,2021年4月9日病情稳定出院。
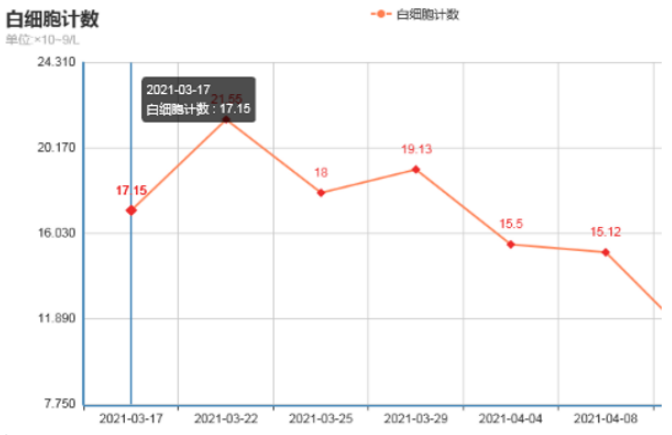
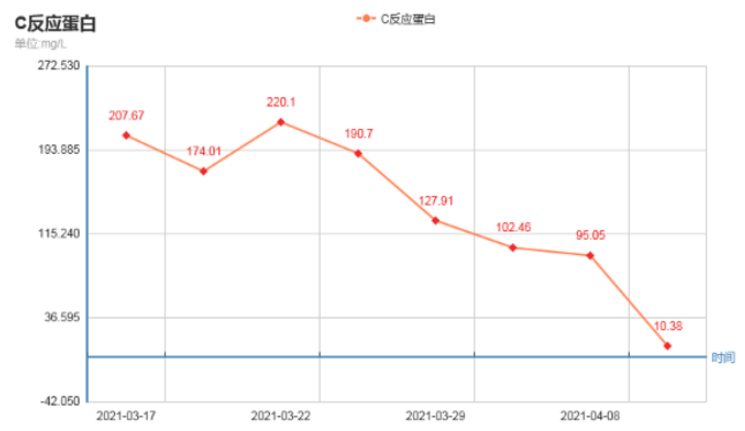
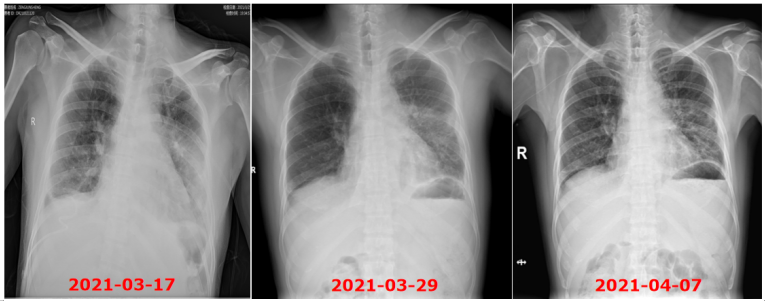
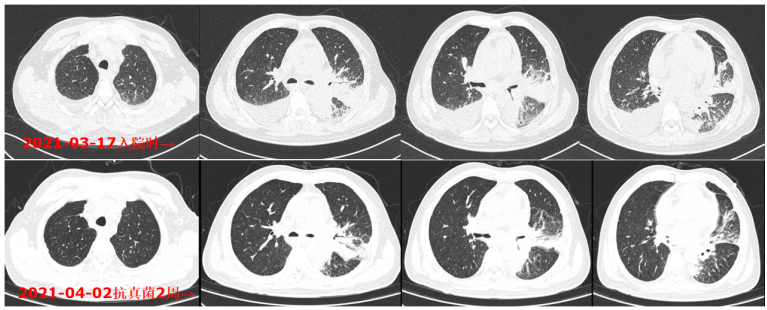
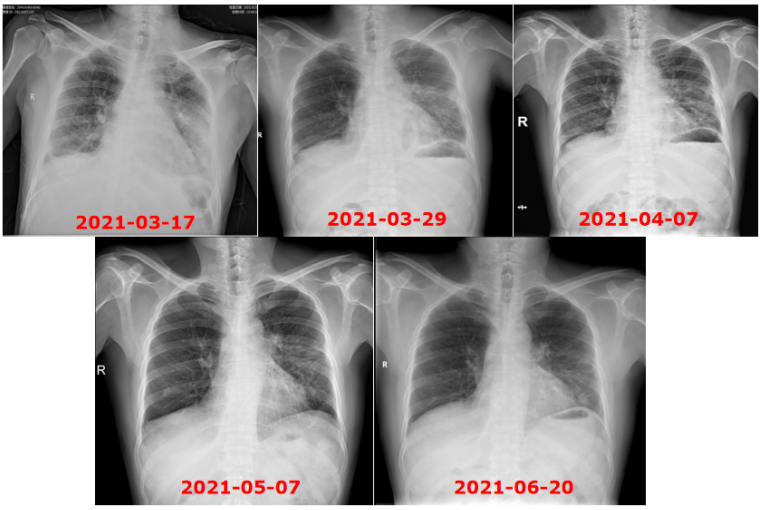
患者治疗过程中白细胞计数及C反应蛋白变化如图8所示,胸片示:左肺渗出性病变逐渐吸收好转(图9);胸部CT示:左肺渗出实变吸收好转,右侧胸腔积液吸收(图10)。
播散型马尔尼菲篮状菌病(重度,HIV阴性):肺部(呼吸衰竭)、胸腔、多发淋巴结、颈部包块(一元论考虑)。
颈部多发包块:NTM待排(二元论考虑,穿刺液已送胸科医院,待明确;治疗后鉴别)。
2型糖尿病。
下肢深静脉血栓形成。
Round 2:抗真菌治疗,喜忧参半

2021年4月9日出院后,患者规律服用伏立康唑抗真菌治疗,精神食欲可,偶有咳嗽,活动后无气促。右颈部包块大致同前,无明显变化。
2021年5月7日来我院门诊复诊,取胸科医院结果示:左锁骨上淋巴结、右颌下淋巴结区穿刺液培养均未查到MTB及NTM,复查胸片提示“左肺门高密度影,较前吸收,双肺感染,较前吸收”。
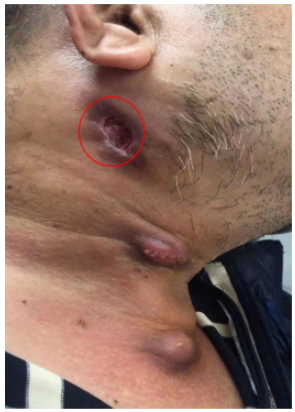
2021年6月8日开始原有右颈部包块及右颌下淋巴结区手术瘢痕处出现破溃并流出血性脓液,右侧乳突及右颈后淋巴结区新发肿大结节,无明显呼吸道症状。
2021年6月19日再次入院。6月21日拍摄图片可见颈部新发包块(图11)。
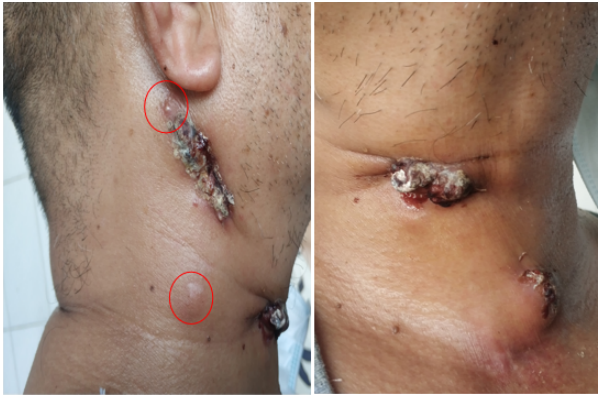
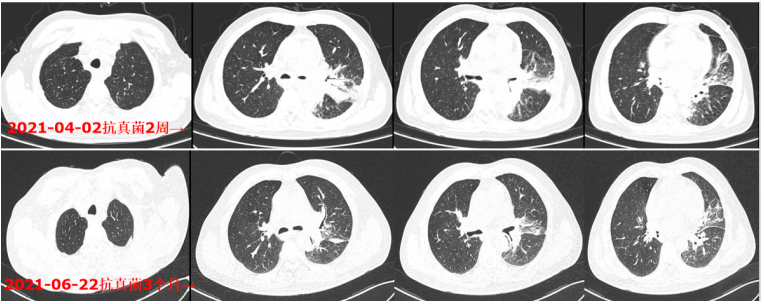
抗真菌治疗3个月,肺部病变好转,颈部包块流脓、新发,如何考虑?
需要考虑二元论!
肺部马尔尼菲篮状菌病:诊断明确,治疗有效。颈部包块流脓、新发:无法用马尔尼菲篮状菌感染解释,此前院外脓液培养见“鸟-胞内分枝杆菌复合体”一次,需要再次明确有无NTM,以及有无其他可能?
诊疗思路:复查肺泡灌洗液mNGS,行颈部包块完整切除,送病理、培养及mNGS检测。
气管镜检查(2021-06-22):原右下基底支及左下背段开口肿胀狭窄,已基本通畅。
气管镜左下肺灌洗mNGS:无MTB、NTM、真菌。
(手术室)胸骨上窝包块切除活检(2021-06-22),病理:慢性化脓性炎,特染四项均阴性,涂片未见抗酸杆菌及细菌真菌;mNGS回报鸟分枝杆菌复合群(序列数6)。
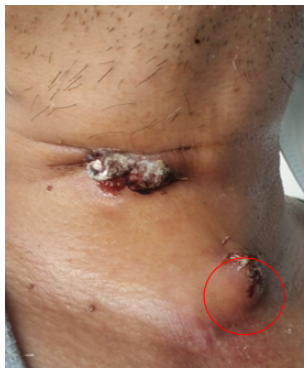
图14为6月22日颈部包块完整切除术后拍摄,红圈内为手术完整切除区域。6月24日患者出院。
马尔尼菲篮状菌病(肺部、胸腔、纵隔及锁骨上淋巴结)。
颈部多发包块:NTM病(鸟分枝杆菌复合群)。
2021年6月25日入住深圳市第三人民医院,予利福布汀0.3 g qd+莫西沙星0.4 g qd+阿奇霉素0.5 g qd+利奈唑胺0.6 g qd抗NTM治疗;继续伏立康唑0.2 g bid抗真菌治疗。2021年7月9日出院,门诊随访。
2021年8月20日广州胸科医院回报:(胸骨上窝组织液培养)鸟-胞内分枝杆菌复合群。
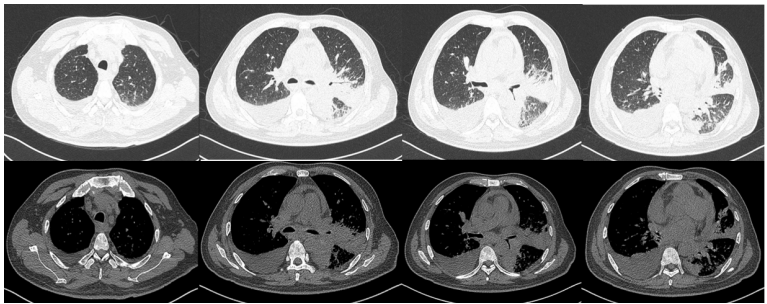
2021年8月23日胸片示:原左肺渗出基本吸收完全(图15)。
Round 3:寻根溯源,追查元凶

马尔尼菲篮状菌病(肺部、胸腔、纵隔及锁骨上多发淋巴结)。
颈部多发包块:NTM病(鸟-胞内分枝杆菌复合群)。
抗INF-γ自身抗体综合征。
2型糖尿病。
文献回顾:抗INF-γ自身抗体综合征


(3)血浆置换治疗: 仅有极少数案例报道了患者在血浆置换治疗后获得了显著的疗效。目前仍缺乏充分的证据表明血浆置换治疗的有效性。
文献回顾:mNGS在TM、NTM感染中的诊断应用

mNGS在马尔尼菲篮状菌感染诊断中的应用,目前只有个案报道,还没有与传统培养方法的大样本对照数据。少数个案报道发现,对于HIV/非HIV患者,样本来源包括血、组织(大网膜、皮损)、房水、肺泡灌洗液。结论基本一致:mNGS有助于早期诊断。个别病例在mNGS阳性后,通过延长标本培养时间(如痰/血)获得阳性结果。2021年1月至2021年6月,广东地区通过mNGS检出马尔尼菲篮状菌共45例,在所有检出真菌中排名第七,检出比例为0.7%;前三位的样本来源分别为BALF、骨髓、血液。与传统培养法相比,mNGS在NTM感染诊断中的总体阳性率差异无统计学意义。
小 结

合理缜密的临床思维是解决疑难疾病诊疗的重要基础,抽丝剥茧、剖根问底,才有望挖掘疾病背后的真正元凶。mNGS在马尔尼菲篮状菌、NTM疑难感染病例的早期诊断中具有重要价值,同时也需要重视与检验科微生物室的沟通反馈。“没有明确宿主因素”的特殊病原体感染患者,应该注意筛查是否存在抗INF-γ自身抗体综合征的可能。AIGA阳性马尔尼菲蓝状菌等感染的标准治疗方案有待更多的积累和探索。
该患者院内外痰及肺泡灌洗液培养均未查到马尔尼菲篮状菌的原因是?
该患者马尔尼菲蓝状菌病的治疗疗程需要多久?
备注:本病例曾获2021年广东省预防医学会呼吸病预防与控制专业委员会“病例大赛一等奖”,相关文献整理截至2021年。
参考文献
作者介绍
李婧
佟万成
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信