登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:张祎
单位:中日友好医院呼吸与危重症医学科
Frank-Starling曲线
Frank-Starling曲线是贯穿整个血流动力学监测中最重要的理论,该曲线反映的是心脏前负荷与每搏输出量之间的关系。当心脏前负荷较为稳定,通过增加心肌前负荷,即可增加每搏输出量。而当心肌超过其最适初长度时,即使再增加心脏前负荷,也不会使每搏输出量增加,甚至可能会出现下降。
脏器灌注指标渗透在临床医生每天的医疗工作中,例如,病史和体格检查、毛细血管充盈时间、平均脉压、实验室检查(BUN/Cr,FeNa,Feurea,乳酸,BE)、尿量、精神状态、X线胸片等,这些指标均能反映患者的脏器灌注情况。
概念
容量状态即前负荷状态。评估患者是否有液体反应性,实际上指的是容量变化是如何导致心输出量的变化。如果容量变化能够使心输出量增加≥15%,则判定为容量反应性阳性。液体治疗能否增加每搏输出量,取决于容量状态落在Frank-Starling曲线的哪一段,以及心肌收缩力和/或心室腔顺应性是否正常。 例如,当心衰时,Frank-Starling曲线通常呈低平状(B曲线),此时患者的心室收缩力及心室腔的顺应性异常,即使处于Frank-Starling曲线的升支,患者可能也很难从液体治疗中获益。
常用的血流动力学监测方法
Swan-Ganz导管是从扬帆远航的帆船中得到了启示,通过一个漂浮的球囊最终实肺动脉压(PAP)和肺毛细血管楔压(PCWP)的测量,通过观察Swan-Ganz导管获得的特征性波形,可以得到相应位置的压力变化。
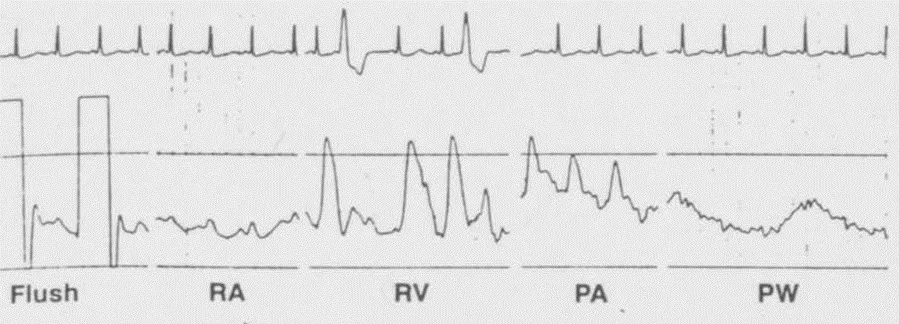
上述CVP和PAWP为静态指标,我们还需要在补液前后观察患者是否出现脉搏压力变异(PPV)、每搏变异(SVV)、下腔静脉(IVC)变异、肺水变化以及全心舒张末期容积等动态指标,这样才能更好地反映液体治疗前后血流动力学的变化。
CVP受到如自主呼吸、正压通气、PEEP、腹腔压等多种因素的影响。目前的文献证实,中心静脉压不能反映容量反应性,也不应单独用于液体管理的临床决策[1]。RISE研究显示,在脓毒症休克患者中,ΔCVP与复苏液体量或MAP改变均不存在有意义的相关性[2]。
在反映左房前负荷方面,PAWP/PCWP是否优于CVP?研究显示,PCWP、ΔPCWP均与每搏量无相关性,PCWP不能预测容量反应性[3]。此外,FACTT研究发现,Swan-Ganz导管不能改善ARDS患者的60天生存率,不能缩短60天脱机时间,且并发症显著增加[4]。因此,目前关于ARDS患者是否仍然需要进行常规的Swan-Ganz导管监测,学界仍持否认态度。对于严重的血流动力学异常及难于管理的患者,我们仍然可以使用Swan-Ganz导管,但要认识到它的优缺点。
为什么压力指标不能全面反映容量情况?这是由于血管会受到外部(胸腔)压力、容量变化以及心腔顺应性的影响。
相关研究证实,ΔPP对容量状态的评估有一定的临床价值。研究纳入40例脓毒症休克患者,控制通气状态,同时监测有创动脉和肺动脉导管,补液500 ml,CI升高≥15%表示有容量反应性,ΔPP≥13%反映容量反应性,具有良好的敏感性和特异性(94%,96%)[5]。一项荟萃分析纳入了22项研究,807例机械通气患者,均无自主呼吸和心律失常,潮气量≥8 ml/kg,PPV预测容量反应性的敏感性和特异性分别为88%和89%[6]。而当患者有较强的呼吸驱动,提高了ΔPP的预测价值[7]。
因此,ΔPP可以用于可以用于临床评估容量状态和容量反应性。但ΔPP也有一定的局限性。这是因为其在临床的实施需要非常严苛的条件(无心律失常、控制通气,无自主呼吸努力,潮气量>8 ml/kg,HR/RR>3.6,呼吸系统顺应性>30 ml/cmH2O,右室功能正常),而实际上真正符合条件的ICU患者仅占2%[8]。
液体反应性评价方法
PLR是取半卧位,头部抬高45°,至少维持5 min,双下肢抬高45°,维持3 min,分别记录血流动力学指标。直腿抬高时血液从腿和下腹部回流至心脏,即短时间内的“自体”输注血液。
一项纳入9项研究的荟萃分析显示,无论患者的通气模式和心率如何,PLR能够良好地预测容量反应性[11],在临床中具有良好的应用前景。一项研究对40名健康志愿者禁食12 h后分别行PLR和补液试验,监测每搏输出量,最终发现ROC曲线下面积为0.9097[12]。这说明,无论对于脓毒症患者还是健康人群,PLR都具有良好的应用价值。
PLR的五个要点:①半卧位45°;②体位调节避免接触患者;③直接测量心输出量(而不是血压)来评估;④必须使用能实时测量心输出量的工具;⑤恢复体位后需复测心输出量,以判断是否回到基线。
PLR在操作时,必须要有客观的方法测量心输出量,心率和血压的变化不能作为参考,腹腔高压患者易出现假阴性(腹腔高压患者做PLR时下肢血流难以全部回流),颅外伤患者不宜实施该操作。尽管如此,PLR仍具有自身优势,例如不受呼吸方式(气管插管/自主呼吸)、心律失常和测量技术影响,无液体过负荷风险。
正压机械通气作用于胸腔,降低右心前负荷。当在呼气末施加PEEP时,会影响右心前负荷。如果在胸腔内施加10 cmH2O PEEP,可见下腔静脉管腔变窄,证实右心仍然处于Frank-Starling曲线的升支。
肺复张过程中,每搏输出量的改变能够预测容量反应性。如果在肺复张过程中发现患者血压低或心输出量低,患者可能对后期的补液产生一定的容量反应性,每搏输出量>30%提示容量反应性良好[13]。
一项研究显示,在20例脓毒症休克机械通气患者中,分别于PEEP 10 cmH2O和20 cmH2O时测量血流动力学指标,补液试验确定容量反应性,结果发现,增加PEEP后,MAP无显著下降,提示容量反应性差[14]。通过呼气末阻断试验,CI增加≥5%,预测容量反应性的敏感性为91%,特异性为100%。此外,呼气末阻断试验预测容量反应性不受PEEP的影响[15]。在机械通气患者中采用控制通气的模式,分别在呼气末和吸气末阻断15 s,同时可以通过经胸超声测量VTI,也可以很好地预测容量反应性,呼气末阻断试验和吸气末阻断试验时,VTI差值预测≥13%,预测容量反应性的敏感性和特异性均为93%[16]。
目前常用的IVC测量指数分为塌陷指数(IVC-CI)、呼吸变异率(ΔIVC)和扩张指数(dlVC)。
一项研究纳入39例机械通气的感染性休克患者,结果发现ΔIVC与ΔCO具有线性相关性(r=0.82),ΔIVC预测容量反应性的阳性和阴性预测率分别为93%和92%[17]。对于机械通气患者,经食道超声测量主动脉瓣峰流速,ΔVpeak≥12%预测容量反应性的敏感性和特异性分别为100%和89%[18]。这些方式都是建立在床旁重症超声基础上。近些年,IVC预测液体反应性的价值受到质疑。胸腔压、腹部因素、测量技术限制以及操作误差都会影响IVC。有研究认为呼气末IVC不能有效预测容量反应性[19]。对此我们仍要客观看待,临床实践中需要观测患者液体治疗前后的反应,而不是单纯依靠一次的指标评价患者是否有容量反应性。
综上,所有的方法都应以临床为出发点,不应被检查所制约。临床治疗前后的效果才是判断的金标准,任何单一的结果都不足以用来进行临床决策,我们应该从患者的反应和客观指标综合判断液体治疗是否合适。此外,我们还应用好工具,用对工具,工具并没有高低之分,只要能够明确其阳性和阴性代表的意义,都可以用来指导临床治疗。
参考文献
[1] Marik E P, Cavallazzi R. Does the central venous pressure predict fluid responsiveness? An updated meta-analysis and a plea for some common sense[J]. Crit Care Med, 2013, 41(7):1774-1781.
[2] Reddi B, Finnis M, Udy A A, et al. The relationship between the change in central venous pressure and intravenous fluid volume in patients presenting to the emergency department with septic shock[J]. Intensive Care Med, 2018, 44(9):1591-1592.
[3] Kumar A, Anel R, Bunnell E, et al. Pulmonary artery occlusion pressure and central venous pressure fail to predict ventricular filling volume, cardiac performance, or the response to volume infusion in normal subjects[J]. Crit Care Med, 2004, 32(3):691-699.
[4] National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network,Wheeler A P, Bernard G R, et al. Pulmonary-artery versus central venous catheter to guide treatment of acute lung injury[J]. N Engl J Med, 2006, 354(21):2213-2224.
[5] Michard F, Boussat S, Chemla D, et al. Relation between respiratory changes in arterial pulse pressure and fluid responsiveness in septic patients with acute circulatory failure[J]. Am J Respir Crit Care Med, 2000, 162:134-138.
[6] Yang X B, Du B. Does pulse pressure variation predict fluid responsiveness in critically ill patients? A systematic review and meta-analysis[J]. Critical Care, 2014, 18(6):650.
[7]Biais M, Ehrmann S, Mari A, et al. Clinical relevance of pulse pressure variations for predicting fluid responsiveness in mechanically ventilated intensive care unit patients: the grey zone approach[J]. Critical Care, 2014, 18(6):587.
[8] Mahjoub Y, Lejeune V, Muller L, et al. Evaluation of pulse pressure variation validity criteria in critically ill patients: a prospective observational multicentre point-prevalence study[J]. Br J Anaesth, 2014, 112(4:)681-685.
[9] Muller L, Toumi M, Bousquet P J, et al. An increase in aortic blood flow after an infusion of 100 ml colloid over 1 minute can predict fluid responsiveness: the mini-fluid challenge study[J]. Anesthesiology, 2011, 115(3):541-547.
[10] Guinot P G, Bernard E, Defrancq F, et al. Mini-fluid challenge predicts fluid responsiveness during spontaneous breathing under spinal anaesthesia: An observational study[J]. Eur J Anaesthesiol, 2015, 32(9):645-649.
[11] Cavallaro F, Sandroni C, Marano C, et al. Diagnostic accuracy of passive leg raising for prediction of fluid responsiveness in adults: systematic review and meta-analysis of clinical studies[J]. Intensive Care Med, 2010, 36(9):1475-1483.
[12] Miller J, Ho C X, Tang J, et al. Assessing Fluid Responsiveness in Spontaneously Breathing Patients[J]. Acad Emerg Med, 2016, 23(2):186-190.
[13] Biais M, Lanchon R, Sesay M, et al. Changes in Stroke Volume Induced by Lung Recruitment Maneuver Predict Fluid Responsiveness in Mechanically Ventilated Patients in the Operating Room[J]. Anesthesiology, 2017, 126(2):260-267.
[14] Wilkman E, Kuitunen A, Pettilä V, et al. Fluid responsiveness predicted by elevation of PEEP in patients with septic shockp[J]. ActaAnaesthesiol Scand, 2014, 58(1):27-35.
[15] Silva S, Jozwiak M, Teboul L L, et al. End-expiratory occlusion test predicts preload responsiveness independently of positive end-expiratory pressure during acute respiratory distress syndrome[J]. Critical Care Med, 2013, 41(7):1692-1701.
[16] Jozwiak M, Depret F, Teboul J L, et al. Predicting Fluid Responsiveness in Critically Ill Patients by Using Combined End-Expiratory and End-Inspiratory Occlusions With Echocardiography[J]. Critical Care Med, 2017, 45(11):e1131-e1137.
[17] Feissel M, Michard F, Faller J P, et al. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy[J]. Intensive Care Med, 2004, 30(9):1834-1837.
[18] Feissel M, Michard F, Mangin I, et al. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock[J]. Chest, 2001, 119(3):867-873.
[19] Vieillard-Baron A, Evrard B, Repessé X, et al. Limited value of end-expiratory inferior vena cava diameter to predict fluid responsiveness impact of intra-abdominal pressure[J]. Intensive Care Med, 2018, 44(2):197-203.
作者简介
张祎
*本文根据“呼吸危重症菁英秀”第三期专题视频整理,感谢张祎医生予以审核。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信