登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
临床工作中应重视支气管肺曲霉菌感染的高危人群,如慢阻肺患者,若合并呼吸衰竭,需提高诊断意识;同时也应重视侵袭性支气管肺曲霉病的早期诊断价值,选取合适的方法,明确诊断,安全、有效地开展治疗。
回顾历史与定位
慢性气道疾病主要涵盖慢性阻塞性肺疾病(COPD)、哮喘、支气管扩张等,这些疾病多以阻塞性通气功能障碍为主。最早报道以COPD为代表的慢性气道疾病患者合并曲霉感染案例的是比利时的Rello教授[Clin Infect Dis, 1998, 26(6):1473-1475],共24例患者,在当时发现这24例COPD患者合并曲霉感染时的病死率是100%。此后,人们逐渐认识到慢性气道疾病患者除了常见的病原体感染之外,也会合并曲霉感染。
图片来源:Clin Infect Dis, 1998 26(6):1473-1475.
2001年,法国Bulpa教授团队研究发现ICU中的重症COPD患者可能会合并曲霉感染。该研究观察了23例入住ICU的重症COPD患者,他们接受了抗真菌治疗,其中16例符合侵袭性肺曲霉病(IPA)诊断,患者在家常规口服激素,病情加重时激素用量增加,通过组织病理学确诊7例,其中6例行气管镜检查,发现5例出现黏膜病变,所有患者胸片表现为进行性或持续性加重的渗出影,12例严重气道痉挛导致急性呼吸衰竭,在ICU接受机械通气,给予两性霉素B治疗,但病死率仍为100%。所以,在当时的情况下,重症COPD合并曲霉感染患者的病死率极高。
2007年,Bulpa教授团队结合他们的经验在Eur Respir J杂志发表了相关综述,文献报道了56例IPA患者,其中77%的患者入院时已经接受了激素治疗,气短和严重喘息为其常见特点,发热、胸痛、咯血不常见,气管镜检查发现气道内炎症表现非常明显,尽管43例患者接受了有创通气和抗真菌治疗,但死亡率仍高达95%。COPD患者合并IPA时预后极差,通过更为迅速的诊断和积极的伏立康唑治疗可能改善这些患者的预后。因此,当重症COPD患者出现严重呼吸衰竭时,尤其是喘息不能缓解,气道阻力高时,应关注是否存在真菌感染。
2010年,法国Guinea教授团队在Clin Microbiol Infect杂志发表了一项研究,该研究回顾性分析了所有因COPD入院并分离出曲霉菌的患者,其中53例患者临床诊断IPA(3.6/1000住院患者),痰培养曲霉阳性患者中IPA占22.1%,GM试验显示42.4%阳性,作者提出了可能与COPD合并IPA相关的5种独立危险因素,包括入住ICU、慢性心脏病、住院前3个月内使用抗生素、住院前3个月强的松使用累积剂量>700 mg,入院至初次痰检曲霉阳性时间段内累积激素用量。该队列的总体平均存活率为64.1%(IPA患者为28.3%,非IPA患者为75.2%)。
2010年后,COPD就成为IPA患病高危因素中一项明确的中等级别危险因素。所以,如果COPD患者转入ICU,同时出现呼吸衰竭,那么曲霉菌感染特别是IPA感染是需要我们密切关注的问题。2013年,西班牙肺部真菌感染共识和欧洲丝状真菌感染高危因素专家共识都提到了COPD是丝状真菌感染的高危因素。
侵袭性气管支气管曲霉菌病(ITBA)往往不侵袭肺实质。ICU中的COPD患者,往往是由于气道黏膜固有防御能力下降,不能及时清除曲霉菌孢子,进而造成局部气道黏膜感染。所以,ITBA也可能是COPD患者合并曲霉感染的高风险的表现形式。
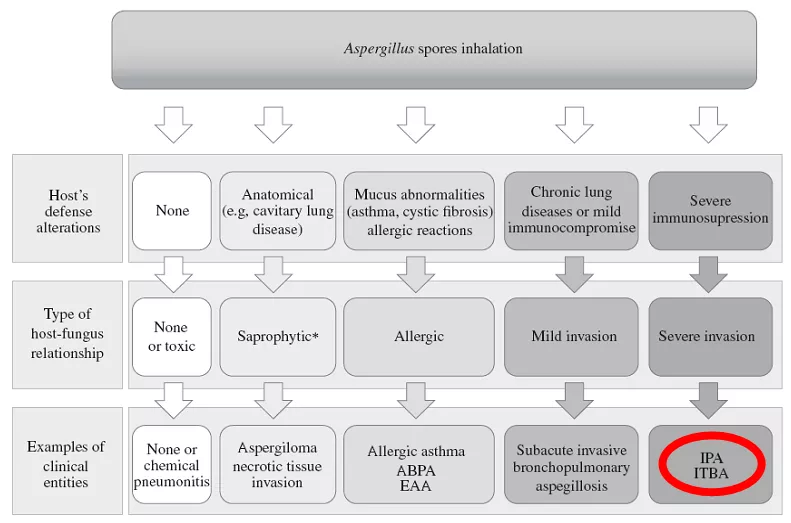 图片来源:The Scientific World Journal, 2011, 11:2310-2329.
图片来源:The Scientific World Journal, 2011, 11:2310-2329.COPD患者合并IPA发病机制还有一个特别大的特点。COPD患者的免疫功能是轻度的免疫抑制。当曲霉菌孢子进入肺实质或气道内后,患者的肺损伤并不是由于或不是主要由于曲霉菌的菌丝侵袭肺组织而造成的,它往往是由于患者在受到曲霉菌侵袭后出现的过度的炎症反应,即偏过敏型的炎症反应,造成全身系统性的炎症反应和局部过度的炎症反应,进而造成机体损伤。所以COPD合并IPA患者大多死于过度的炎症反应和肺损伤。
诊断和治疗
2007年,Bulpa教授针对COPD合并IPA提出了一系列诊断依据,其中尤其强调对于COPD患者来说,既往应用过激素治疗,而且GOLD分级3~4级,最近有呼吸困难急性加重,有提示性的胸部影像学特征(多为新发进行性进展的病灶)以及病原学证据(2次血GM试验阳性,同时有痰/肺泡灌洗液阳性培养结果),才能诊断COPD合并IPA。此外,除了肺实质的IPA诊断之外,曲霉菌气管支气管炎也是尤其需要注意的问题。
COPD合并IPA不是典型的感染过程,以类似于肺炎或感染浸润的表现为主。广州军区总医院2006—2009年的数据显示,与非IPA患者相比,影像学方面的进展提示其可能是IPA。北京朝阳医院的数据显示,如果COPD患者胸部CT出现多发的结节影以及晕征、空洞或楔形实变,这些非典型的炎症反应表现可能是COPD合并IPA的主要的影像学表现。通过敏感度和特异度分析发现,COPD合并IPA缺乏典型的影像学特征,所以仍需要依赖病原学检测进行诊断。故曲霉涂片和培养、GM试验及气管镜检查均是IATB的主要诊断方法。IATB+IPA是同一种疾病的两个阶段或两种表现形式,所以提出了IBPA(invasive bronchial-pulmonary asperaillosis)的概念,即侵袭性支气管肺曲霉病的表现形式。我们研究发现,早期10余例病例中很多合并气道感染,所以我们提出早期行气管镜检查和病原学检测,同时观察气管黏膜,并进行活检。如果ICU患者痰培养阳性,提示诊断IPA的可能性较大;如果普通病房患者痰培养阳性,在判断感染或是定植方面需要更加慎重[Chin Med J (Engl), 2012, 125(17):2973-2978]。
国外也提出了相似的流程,即当发现影像学有变化,同时有阳性病原学结果时,需要早期启动抗真菌治疗。
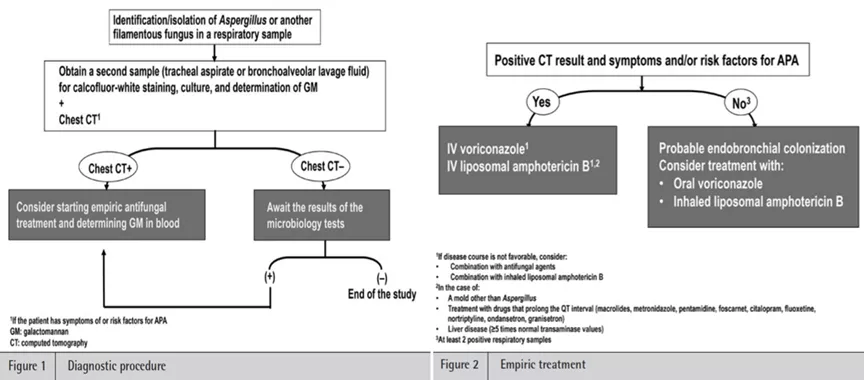
关于GM试验在COPD合并IBPA中的诊断价值也进行了一些探索。早期研究发现,连续2次GM试验中有1次阳性,可能有助于重症COPD-IA早期诊断的建立。那么BALF-GM试验的诊断价值会更高吗?研究显示,BALF-GM试验的敏感度(88%)和特异度(87%)明显提高,并将阳性界值提高到了0.8,可以进一步使敏感度接近90%以上。此外,我们也提倡早期气管镜下黏膜活检,能够帮助确诊IPA,患者插管后早期气管镜下可见黏膜的特征性改变,如伪膜和白斑等,而且此种方法出血风险低,创伤较小。
针对AECOPD-IA的诊断标准目前有3个,分别是Bulpa教授提出的针对COPD合并IPA诊断标准、EORTC的常规诊断标准以及针对ICU患者合并IPA的诊断标准,但上述标准对于危险因素和影像学表现的诊断要求并不统一。我们在Bulpa教授提出的诊断标准基础上进行了修订,放宽了危险因素(对激素无特殊要求)、放宽了微生物学标准(加入BALF-GM试验)、放宽了影像学标准(不再强调特异性表现)。
Bulpa教授对既往诊断标准进行了分析和评价,最终认为ICU标准最优,诊断特点包括:接受全身激素、曲霉阳性、呼吸衰竭、胸片异常、无需区分GOLD分级。2020年,Bulpa教授在Semin Respir Crit Care Med发表了修正的诊断标准的结果,与我们目前应用的标准基本类似。
国内苏欣教授团队也发表了COPD合并IPA患者的诊断预测模型,该模型的核心要素包括GOLD 3~4级、激素使用剂量>265 mg、既往使用过广谱抗生素以及营养不良。随着病例的积累,会有越来越多的危险因素被发现,并帮助我们早期识别和判断COPD患者合并IPA的可能。治疗方面,两性霉素B、棘白菌素类以及唑类药物可以联合也可以单独应用,但效果并不理想,患者病死率仍然较高。ICU中COPD合并IA患者的整体病死率为44.7%,近年研究提示新型抗真菌药物的应用使COPD合并IA患者死亡率明显下降,维持在50%~60%,但仍处于较高水平。
病例分析
病例1
一般情况:COPD患者,55岁,男性,反复咳嗽、咳痰20年,气短10年,再发加重1周入院。 现病史:20年前无明显诱因的咳嗽、咳痰,少量白痰,此后病情时有反复,未系统治疗。10年前,咳痰症状加重,活动后气短,诊断为COPD。近2年,气短加重,上三楼即感觉明显喘憋,长期使用沙美特罗替卡松粉吸入剂,日常活动明显受限。1周前,受凉后出现咳嗽加重,咳黄黏痰,不易咳出,伴有阵发喘憋,发作时大汗,不能平卧。外院给予左氧氟沙星、哌拉西林他唑巴坦抗感染,甲强龙、多索茶碱平喘,间断无创呼吸机辅助呼吸。1天前病情无好转迹象,遂来我院就诊,收入病房。 既往史:冠心病病史4年,高血压病史半个月,最高血压200/120 mmHg;否认糖尿病病史;无药物和食物过敏史;吸烟30余年,每日40支,现已戒烟半年。 入院查体:T 36.5℃,P 129次/min,R 24次/min,BP 133/99 mmHg;神清,端坐呼吸,大汗淋漓;桶状胸,双肺呼吸动度对称减弱,双肺叩诊呈过清音;双肺呼吸音低,可闻及散在干啰音,未闻及明显湿啰音;心律齐,心音有力,未闻及病理性杂音,P2>A2;双下肢轻度凹陷性水肿。 辅助检查:入病房后血气分析(NPPV 12/4 cmH2O,FiO2 0.35),pH 7.318,PaCO2 83.1 mmHg,PaO2 55 mmHg。血常规示WBC 8.4×109/L,NEU% 80.51%。由于患者呼吸衰竭较重,遂转入RICU。 初步诊断:AECOPD(慢性支气管炎/阻塞性肺气肿,Ⅱ型呼吸衰竭);冠心病(心功能不全);高血压3级(极高危组)。 影像学检查:患者入科后第2天行胸部CT检查,结果示:桶状胸,轻度肺气肿,双肺纹理轻微增粗,无明显结节、斑片或大片渗出影,影像学上表现并不明显。
入科第2天行血GM试验,结果回报2.342。痰涂片找到菌丝,PCT 0.05 ng/ml,无明显发热,WBC 8.23×109/L,NEU% 65.7%。持续无创通气,给予莫西沙星、头孢哌酮舒巴坦和伏立康唑治疗。至第4天,患者病情无明显缓解,PaCO2逐渐下降。虽然前期痰涂片找到菌丝,但并未引起重视,因为患者发热症状,血象不是很高,且无侵袭性肺曲霉菌感染的影像学征象。第5天,痰培养提示烟曲霉,给予伏立康唑治疗后,患者喘憋症状无明显好转,多为半卧位或端坐呼吸。
床旁纤支镜下可见气道内无明显的黏膜充血水肿,局部黏膜隆起,吸出少量白黏痰,气管隆突相对锐利,间嵴锐利,局部黏膜少量白斑,取标本行黏膜活检,并送病原学检查,血GM试验回报0.242,较前下降。BALF-GM回报2.144,明显升高,痰培养多次培养出烟曲霉,因此考虑是否存在气道内曲霉感染。给予伏立康唑后,患者喘憋症状无缓解。 如果存在真菌感染,一定会播散至肺实质,引起影像学进展。但第9天患者胸部CT与之前相比并无明显进展。患者究竟是不是曲霉感染?
第10天,在继续使用头孢哌酮舒巴坦和伏立康唑的情况下,患者喘憋明显好转。第12天,患者能够脱离无创通气,而且间断鼻导管吸氧能够维持氧合,PaCO2维持在50~55 mmHg,无其他感染征象,遂将患者转出RICU。
第12天,病理检查结果显示气道腔内可见大量曲霉菌菌丝,侵袭至黏膜内。所以该病例是侵袭气道的曲霉菌感染,引起COPD患者严重喘息。最终的诊断是AECOPD,伴侵袭性曲霉菌气管支气管炎(IATB)。 回顾该病例的诊治过程:患者做了两次胸部CT,肺内并无明显的曲霉菌感染,通过气管镜检查发现气道内的微小病变,这是曲霉菌侵袭气道黏膜所致。患者有吸入激素和近期短期的全身系统激素使用情况,最终通过病理检查确诊IATB,给予抗真菌药物治疗后,短期内(1周左右)病情得以缓解。1年后随访,患者一般状态较好,病情未再反复,亦未再使用抗真菌药物。 |
病例2
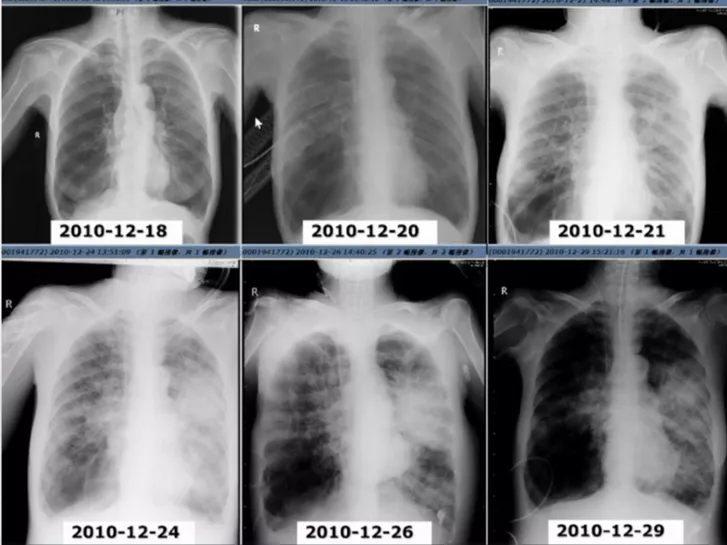 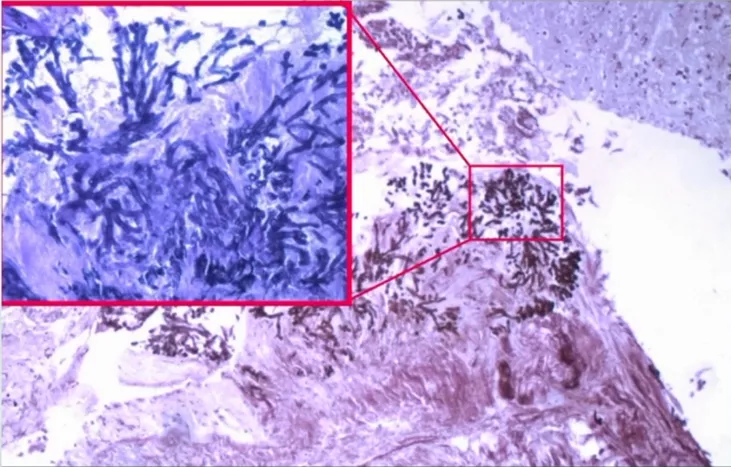 |
病例3
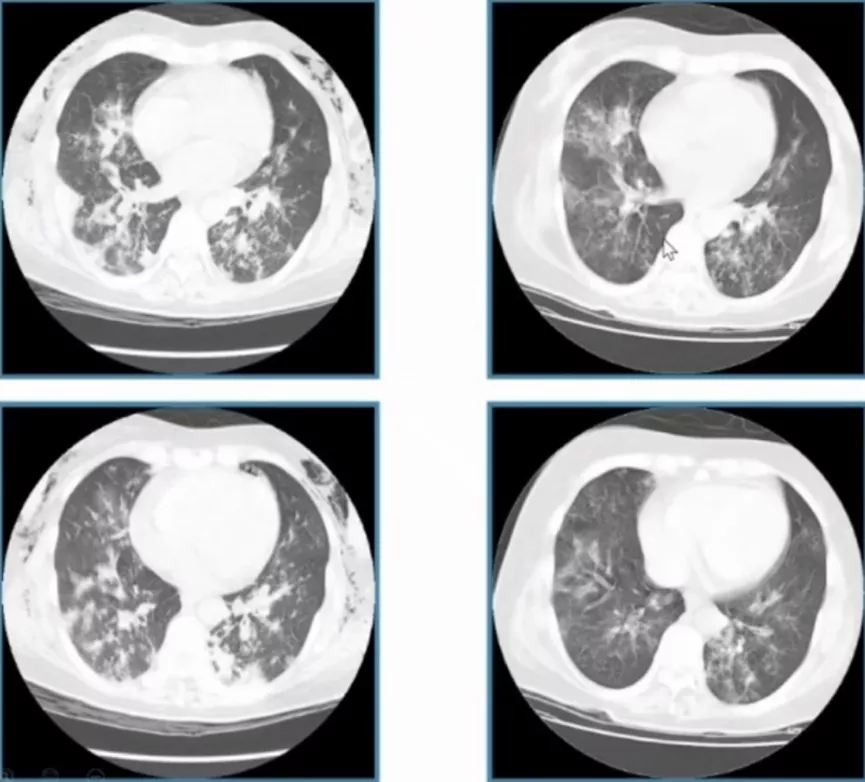 |
小 结
AECOPD已成为IBPA的高危人群,此类患者合并呼吸衰竭时,应提高诊断意识。
重视IBPA理念的早期诊断价值,尤其是IATB阶段的早期诊断价值;血清GM试验和BALF-GM试验对IBPA的诊断具有积极价值;气管镜是早期诊断的重要方法,提倡早期气管镜下黏膜活检,能够尽快确诊IBPA,镜下可见伪膜、白斑样病变。
AECOPD合并IBPA的治疗在早期为联合治疗,因为患者通常病情危重,病死率高,治疗过程中需要关注药物的安全性和有效性。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信