登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
重症COVID-19患者存在“Co-infection”,不容忽视,尤其是合并COVID-19相关肺曲霉病(COVID-19-associated pulmonary aspergillosis,CAPA)。病死率非常高。对于CAPA,“Co-infection”与“Co-exist”一定要仔细鉴别,不可漏诊,亦不可过度诊断。
CAPA可能的发病机制
2019年12月,SARS-CoV-2首次被分离出,随即席卷全球。2021年7月5日,WHO官方网站显示,全球感染COVID-19的患者已经达到了一亿八千万,近400万的患者因此死亡。浏览Web of Science发现,COVID-19相关文章已经发表超过16万篇,对这16万篇文章进行聚类分析发现研究热点有所改变,从2019年12月的流行病学特征、宿主易感性、疾病特征,到后期的药物研发,再到半年前的疫苗研发,再到当前的研究热点——“Co-infection”,即共同感染,主要关注COVID-19近期和远期的宿主并发症。
1952年的一篇文献报道了第1例流感相关性曲霉感染的51岁女性患者,非经典的易感宿主, 且无基础慢性疾病,流感后发热伴气急,入院16天后死亡,尸检提示左肺空洞并可见曲霉菌菌丝。经检索pubmed,发现流感季节侵袭性肺曲霉病发病率略高。基于此,2018年Lancet上发表的一项前瞻性研究假设流感是否可以作为IPA独立的宿主因素。该研究纳入了7个流感季、7家ICU的800多例患者进行比较,COX回归分析显示流感确实是引起IPA的独立危险因素,其校正OR值高达5.19。
但现实中仍然存在很多疑问:流感相关性肺曲霉病(IAPA)如何定义?如何鉴别共生长与共感染?研究显示,对于ICU中的H1N1患者,合并IPA和非合并IPA患者病死率并无显著的统计学差异。因此,我们也在反思:关于呼吸道病毒继发的感染,通常我们会漏诊,但有没有过度诊断的可能?病原体和宿主究竟是共生长/共存状态,还是共同感染状态?
2020年1月30日,金银潭医院首次通过描述性研究报道,在COVID-19基础上,可疑合并真菌感染者4例,可疑合并细菌感染者1例。随即的研究提示,在COVID-19继发HAP患者中检出了CRKP、黄曲霉、烟曲霉、产ESBL的肺炎克雷伯菌和铜绿假单胞菌、黏质沙雷菌(ESBL-)及白念珠菌。
CAPA可能的发病机制或许与IPA有共同之处,但也存在不同。病毒与肺泡上皮细胞的体外共生长实验证实:上皮屏障破坏,彼此连接受损,纤毛清除功能减弱及免疫功能紊乱或失调,进而使曲霉更容易入侵。另外,呼吸道病毒损伤气道柱状纤毛上皮细胞导致其坏死,累及终末细支气管和肺泡,使基底膜细胞增生,但功能不佳,而增生的细胞为无纤毛的鳞状上皮,机体因缺乏纤毛的清除功能更加易感。
SARS-CoV-2通过与Spike蛋白及血管紧张素转换酶2(ACE2)受体结合,靶向并入侵上皮细胞和Ⅱ型肺细胞,使气道黏膜屏障受损。另有研究显示,跨膜蛋白酶TMPRSS2对S1/S2结构域的切割导致Spike蛋白激活,从而促使病毒通过ACE2进入靶细胞,同时也为真菌入侵提供了途径。
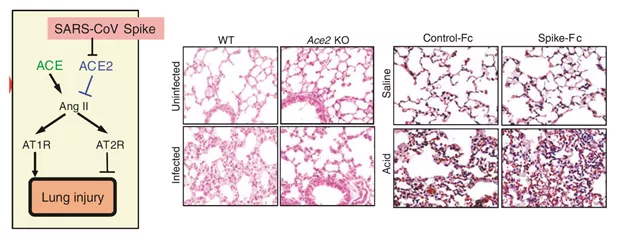
图片来源:J Virol, 2011, 85(9):4122-4134.
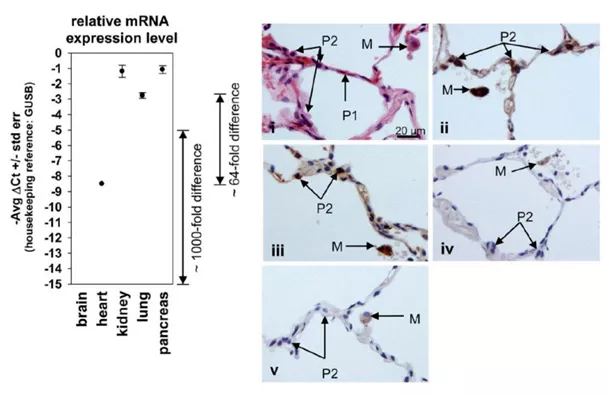
我们在武汉市第三医院支援期间开展了一项针对246例新冠肺炎患者的回顾性分析,结果发现重症的危险因素包括:外周血淋巴细胞计数进行性降低,C反应蛋白进行性升高,组织氧合指标—乳酸进行性升高,高分辨CT显示病变范围快速扩大。SARS-CoV-2主要是消耗T淋巴细胞亚群。细胞免疫缺陷可能是COVID-19感染后易继发细菌和真菌感染的主要原因。
图片来源:Yu Yuetian Peer J. 2020 Sep 1;8:e9885.
除了T淋巴细胞数量减少以外,功能方面也不容忽视。淋巴细胞数量下降,其功能可能是有缺陷的。对SARS-CoV-2的免疫反应缺陷可能会导致病毒不受限制地复制,还为获得继发性感染(如CAPA)创造了有利条件。
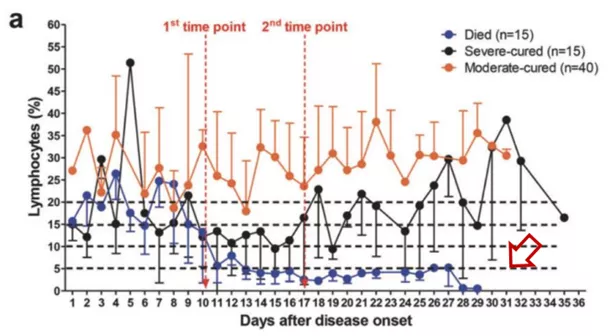
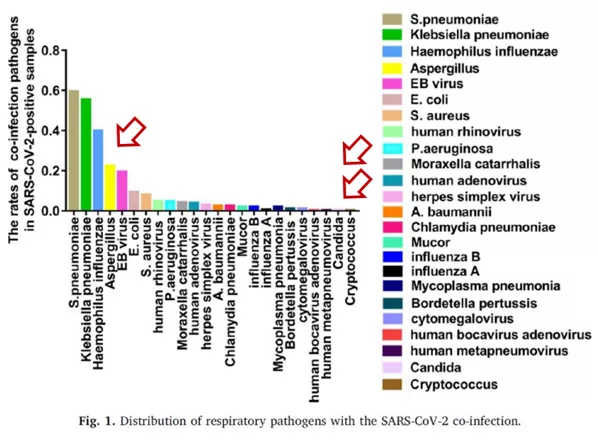
截至2020年6月,仅有35例CAPA被报道。目前确诊的CAPA病例数相对较少,存在漏诊,但也存在过度诊断。对于疑似CAPA患者,ICU医生会积极给药,因为我们担心这些快速进展的危及生命的感染,最终导致患者临床预后不佳。
截至2020年6月,仅有35例CAPA被报道。目前确诊的CAPA病例数相对较少,存在漏诊,但也存在过度诊断。对于疑似CAPA患者,ICU医生会积极给药,因为我们担心这些快速进展的危及生命的感染,最终导致患者临床预后不佳。
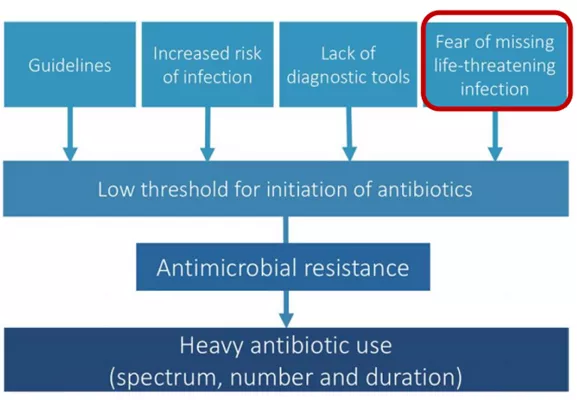
2020年6月,发表于J Fungi杂志发的一项研究显示,在关于CAPA的众多文章中,完全通过病理证实的仅有35例。所以诊断方法需要完善,仅以血清GM为诊断标准,敏感性不佳。尤其对于ICU患者,GM试验的敏感度受多种因素影响,如是否使用β-内酰胺类抗菌药物、曲霉菌种、宿主因素、保存因素和cut off值等,虽然GM试验的特异性很高(>85%),但其敏感度波动很大(29%~100%)。
无论是IAPA还是CAPA,都不是经典的免疫缺陷宿主。考虑患者存在高风险性,是基于对该疾病具有高度认识的基础上。那么COVID-19期间是否使用最佳诊断工具保证检出率?有三方面值得我们关注:①COVID-19患者气道标本的采样风险;②COVID-19期间医务人员的送检意识;③实验室条件、人力配置需平战结合。
CAPA宿主因素及疾病特征
CAPA和IAPA都是呼吸道病毒继发的侵袭性肺曲霉病,有相似之处,也存在不同,二者的发病率和病死率均相对较高,都是在感染了呼吸道病毒短期之内诱发的侵袭性肺曲霉病,缺乏典型的侵袭性真菌感染的宿主因素,入院后疾病诊断的时间相似,以及存在淋巴细胞减少症。2020年,发表于N Engl J Med杂志的RECOVERY研究显示,对需要使用机械通气的危重患者,糖皮质激素治疗可以改善预后。在此之前,有关糖皮质激素的使用存在争议,没有指南共识的推荐。该研究之后,可能更多危重COVID-19患者会使用糖皮质激素,以期能改善预后,但它会进一步抑制患者的免疫功能。
另外一项2021年发表于Lancet的研究显示,使用了IL-6受体阻滞剂—托珠单抗的患者,其死亡率较低,出院率较高,托珠单抗改善了住院 COVID-19缺氧和全身炎症患者的生存率和其他临床结果。但无论是糖皮质激素还是托珠单抗,这些研究都没有提供关于远期并发症的信息,有无继发真菌感染。另有研究显示,若COVID-19患者使用了大剂量糖皮质激素或免疫抑制剂,可能发生”superinfection”,大部分是病毒和真菌感染,此种感染一旦发生在肺,患者病死率将增高。
COVID-19影像学无特异性,典型的影像学表现是靠近肺边缘的多发的磨玻璃样结节,会有很多细小的肺动脉栓塞以及肺的缺血性坏死。不典型的患者可以在肺叶中出现晕轮征或反晕轮征。如下图,A、B、D、F为COVID-19典型影像学,双侧外侧野多发磨玻璃样结节;C、E为不典型影像学,由肺细小动脉栓塞导致晕轮征或反晕轮征。
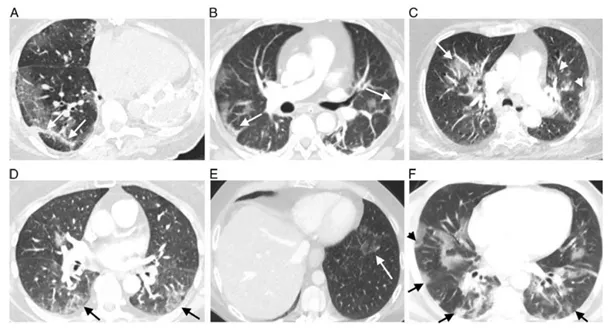
下图中,A为确诊的CAPA,B为无真菌感染。这2例患者都存在肺曲霉病中经常发现的局灶性结节及实变,并伴有相邻的磨玻璃样变(*)
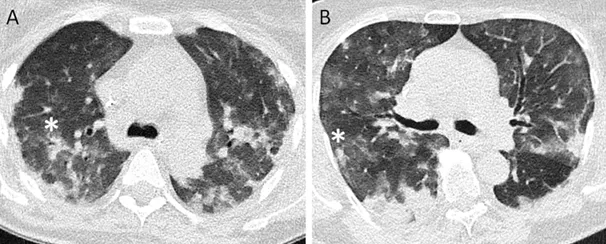
图片来源:Lancet Infect Dis, 2021, 21(6):e149-e162.
CAPA的定义及诊断
对于CAPA的诊断仍存在一些争议,很多专家提出了意见,正反方均有。肺活检并发症多,对于机械通气患者并发气胸的风险增高。支气管肺泡灌洗一方面产生气溶胶污染环境,另一方面是使操作者暴露于风险中。而非支气管肺泡灌洗(插管患者通过封闭的抽吸系统直接注入10~20 ml生理盐水回收),仅被批准用于诊断VAP,未完全批准用于检测IPA的抗体及PCR。人工气道吸引及痰液不能完全代表下呼吸道分泌物,相关标志物检测未被批准,即使标本阳性率高,常代表定植。血清G/GM试验的假阴性率高。此外,血清GM试验对排除CAPA的价值下降,已证实的CAPA病例,仅有20%的患者显示出血清GM试验的阳性结果。多数CAPA是由BALF GM及胶体金免疫层析(LFD)诊断。诊断IPA,BALF GM的敏感性高于血清GM试验。
图片来源:Antimicrob Agents Chemother, 2010, 54(11):4879-4886.
众所周知,不同指南所制定的BALF GM cut off值不统一。2016年IDSA给出的BALF GM cut off值>0.5。2017年ESCMID-ECMM-ERS提出慢阻肺BALF GM cut off值>1.0,ICU>0.5,肺移植高达1.5。2021年3月,EORTC/MSGERC又提出ICU中BALF GM的cut off值>0.8。这也给临床医生造成很大困惑。
LFD目前在临床逐渐推广,它是在试剂盒中提前包埋了JF5的单克隆抗体。研究显示,如果单用LFD进行诊断分析,其敏感性和特异性均不理想,接近80%。如果LFD联合BALF GM>1.0进行联合诊断,其对IPA的敏感性和特异性均可以接近95%。所以,临床上我们倾向于使用LFD和BALF GM进行联合诊断。
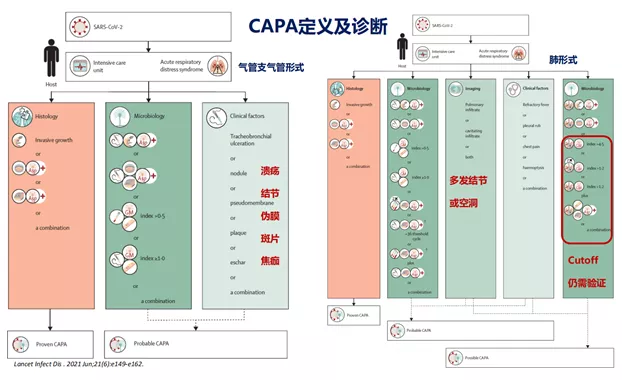
来自于的Lancet Infect Dis的专家共识推荐将CAPA的定义和诊断分为两部分,第一部分是气管支气管形式的,第二个部分是肺形式。如果是气管支气管形式,如果确诊,仍需通过病理活检;如果是临床诊断,气管镜检查则是必须的,它可以通过气管镜直接观察气道壁的溃疡、结节、伪膜、斑片、焦痂等典型性的气道病理性改变,然后再结合支气管肺泡灌洗或血GM试验,其中血GM指数定义为>0.5,BALG GM指数>1.0。如果是肺形式,影像学虽然不典型,但多发结节或空洞,COVID-19患者中仍比较少见,如果患者出现了肺部渗出和多发结节或空洞,要高度怀疑CAPA。如果寻求微生物学证据,建议进行镜检和培养,如果没有病原体检出,血清GM>0.5,同时结合LFD和BALF GM>1.0。如果是疑似诊断,可以进行非支气管镜盲灌洗,指南定义的cut off值>4.5,如果仅有一次>4.5,则为疑似诊断;如果一次没有达到4.5,两次>1.2也是可以的。但这些cut off值均未经过大样本、前瞻性临床研究进行验证,这也是今后研究方向之一。
CAPA的治疗及相关注意事项
图片来源:Intensive Care Med, 2018, 44(11):2000-2003.
小结
重症COVID-19患者存在Co-infection,不容忽视,尤其是合并CAPA。
对于CAPA,Co-infection与Co-exist一定要区分清楚,不可漏诊,也不可过度诊断。
非培养性诊断方法发展快,临床医生需知晓其原理,妥善应用,做好CAPA诊疗工作。
本文由重症肺言根据“重症肺言之ICU内侵袭性支气管肺曲霉菌病论坛”整理,感谢余跃天教授审阅修改!
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信