登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:高景
单位:郑州大学第一附属医院呼吸与危重症医学科
流行病学
脓毒症定义和诊断标准
从我们熟知的1991年Sepsis 1.0到2016年Sepsis 3.0,脓毒症的定义和诊断标准不断更新[1-3]。Sepsis 1.0将脓毒症定义为感染+全身炎症反应综合征(SIRS),其中SIRS的诊断标准包括:体温>38℃或<36℃;心率>90次/min;呼吸频率>24次/min,或PaCO2<32 mmHg;白细胞计数>12×109/L或<4×109/L,或未成熟细胞>10%。但这一标准缺乏特异性和敏感性,不能反映器官功能损害。基于此,2001年发布了Sepsis 2.0诊断标准,它是在Sepsis 1.0的基础上增加全身一般情况、炎性参数、血流动力学参数、器官功能不全参数、组织灌注参数,相较于Sepsis 1.0,Sepsis 2.0的诊断过于复杂,对患者预后的预测价值不高,因此未能得到临床的认可和应用,广泛应用的仍是Sepsis 1.0诊断标准。2016年更新的Sepsis 3.0诊断标准强调“感染+SOFS评分≥2分”,其核心是感染导致的致命的器官功能障碍失调的机体反应。
脓毒症是指因感染引起的宿主反应失调导致的危及生命的器官功能障碍,其与感染的区别在于宿主反应异常或失调以及存在器官功能障碍。所以说脓毒症是一种综合征,由病原体和宿主因素(如性别、种族和其他遗传决定因素、年龄、共病、环境)作用形成,其特征随着时间的推移而演变。脓毒症引起的器官功能障碍可能是隐匿的,任何无法解释的器官功能障碍都会增加潜在感染的可能性。脓毒症的临床和生物学表型可由于既往存在的急性疾病、长期并存病、药物治疗和干预措施加而改变。
对于感染或疑似感染的患者,当脓毒症相关序贯器官衰竭(SOFA)评分较基线上升超过2分可诊断为脓毒症。SOFA的构成要素(如肌酐或胆红素水平)需要进行实验室测试,因此可能无法及时捕捉到单个器官系统的功能障碍。SOFA评分为2分或以上的患者在假定感染的综合医院人群中的总体死亡风险约为10%,这大于ST段抬高心肌梗死的总死亡率(8.1%)。根据患者的基线风险水平,与SOFA评分<2分的患者相比,SOFA评分为2分或更高时,死亡风险会增加。
SOFA评分标准
在医院外、急诊室或综合医院病房,如果成人患者至少有以下2项临床标准,共同构成一个新的床边临床评分,称为快速SOFA(qSOFA),可以迅速确定为更可能出现脓毒症典型的不良结果:呼吸频率为22次/min或更高,意识改变,收缩压≤100 mmHg。如果符合qSOFA标准中的至少2项,应进一步评估患者是否存在脏器功能障碍。
qSOFA评分标准
虽然qSOFA在重症监护室不如SOFA评分2分或更高有效,但其不需要实验室测试,可以快速、反复地评估。工作组建议,使用qSOFA标准促使临床医生进一步调查器官功能障碍,恰当地启动或升级治疗;如果尚未采取此类行动,考虑转诊至ICU或增加监测频率。工作组认为,阳性qSOFA标准也应促使识别可能的感染患者,而这些患者之前可能未被认为是感染。
脓毒症休克是指脓毒症合并严重的循环、细胞和代谢紊乱,其死亡风险较单纯脓毒症更高。脓毒症休克是脓毒症的一个亚型,其潜在的循环和细胞代谢异常大大增加了患者的死亡率。
脓毒症休克诊断标准:在脓毒症的基础上,出现持续性低血压,在充分容量复苏后需血管活性药维持平均动脉压(MAP)≥65 mmHg,以及血乳酸水平>2 mmol/L(18 mg/dl)。
对于感染或疑似感染者,可以在床旁行qSOFA评分,如果qSOFA<2分,仍然考虑有脓毒症可能,需要进一步进行临床检测,甚至需要进一步评估患者是否存在器官功能障碍。如qSOFA≥2分,需要进行SOFA评分,如果SOFA≥2分,考虑脓毒症,然后再评估容量状况,根据脓毒症休克诊断标准判断是否为脓毒症休克。
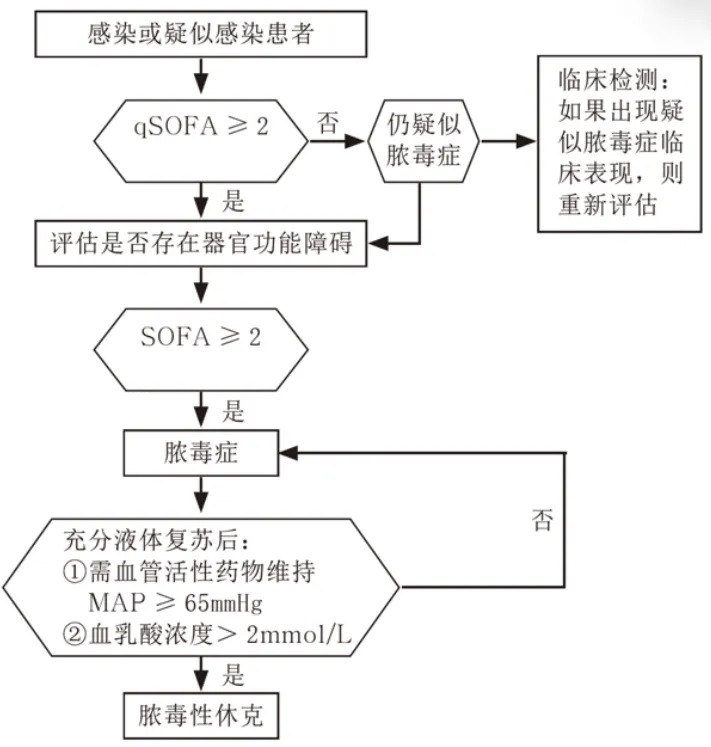
脓毒症筛查流程
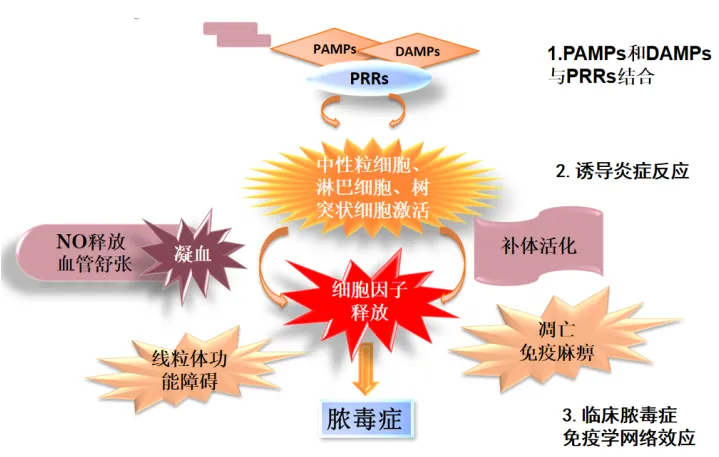
PAMPs(病原相关性分子)和DAMPs(损伤相关分子)与PRRs(模式识别受体)结合后,中性粒细胞、淋巴细胞、树突状细胞激活,释放大量细胞因子,激活细胞内转导途径。各种介质相互作用,引发级联反应,增强炎症过程。不断增强的炎症反应导致炎症介质(如一氧化氮)释放,血管舒张,凝血功能异常,补体活化,线粒体功能障碍,炎症细胞凋亡和免疫麻痹,最终导致脓毒症的发生,进而形成临床脓毒症免疫学网络效应[4]。
从Sepsis 3.0定义可以发现,脓毒症的核心是器官功能障碍,它可以累及全身各个器官和系统,如中枢神经系统、心血管系统、呼吸系统、凝血系统以及肝、肾等脏器。因此,临床上出现不明原因的器官功能障碍时,考虑脓毒症可能,需要进一步完善诊断性检查进行评估。脓毒症器官功能障碍的病理生理学涉及复杂的血流动力学和细胞机制,因此治疗的首要目标是恢复和维持细胞充足的氧供。脓毒症引起的单器官功能障碍很少见,患者的死亡率与受影响器官的数量有关。脓毒症患者的大多数器官功能障碍是可逆的。
脓毒症肝损伤
1. 概述及机制
肝脏是脓毒症最常见的损伤器官,脓毒症早期即可出现肝功能障碍。研究显示,脓毒症相关肝功能不全和肝衰竭发生率为34%~46%和1.3%~22%。如果脓毒症患者合并了肝功能障碍或肝衰竭,其死亡率高达54%~68%[5]。脓毒症患者早期肝功能障碍是预后不良的独立危险因素。
继肠道上皮屏障之后,肝脏构成了第二道防线,消灭入侵的细菌和细菌产物,具有免疫监测和细菌清除的作用[6]。在脓毒症和脓毒症休克过程中,肠道和其他器官之间也会发生相互作用。脓毒症过程中,多种因素可导致肠道功能障碍,肠道功能破坏(如肠道微生物菌群失调)可导致组织损伤和其他器官系统功能障碍。在治疗脓毒症或脓毒症休克时会使用一些抗菌药物和血管活性药物,危重患者需给予肠外营养治疗,肠道菌群失调进而释放炎症因子,使上皮细胞凋亡增多以及通透性增加,破坏了肠道黏膜的完整性;病原体和病原相关损伤分子可以通过门静脉进入血液循环,同时也会有肠源性有害物质释放,最终导致肝肾等脏器损伤[7]。
图源:Nat Rev Nephrol, 2018, 14(7):417-427.
在脓毒症过程中,细菌及细菌产物如内毒素通过肝动脉和门静脉到达肝脏。此外,与缺血肝细胞或胆管细胞损伤相关的全身细胞因子和损伤相关分子(DAMPs)在肝窦积聚。星状细胞和肝巨噬细胞(Kupffer细胞)通过产生大量的炎症细胞因子(TNF、IL-6、IL-1β)和趋化因子(CCL2)对危险信号进行响应,来吸引其他免疫细胞(如中性粒细胞和单核细胞),并向肝细胞提供信号,使其从稳态向炎症基因和蛋白表达程序转换。这一过程涉及急性期蛋白(APPs)的诱导,如血清淀粉样蛋白a1 (SAA)和其他炎症介质(IL-8和CXCL1)。中性粒细胞[通过细胞间黏附分子1(ICAM1)和淋巴细胞功能相关抗原1(LFA1)相互作用]和单核细胞在肝脏中积累,有助于抗菌防御[通过中性粒细胞细胞外陷阱(NET)的形成或吞噬]以及免疫介导的肝细胞损伤(通过TNF诱导凋亡)。肝脏中的多种类型细胞在细菌吞噬和清除中发挥作用,中性粒细胞通过Kupffer细胞分泌的趋化因子在肝窦中迁移并累积。然后,中性粒细胞和血小板相互作用,促进中性粒细胞胞外陷阱(NET)释放,以捕获和消除微生物[8]。
图源:Nat Rev Gastroenterol Hepatol, 2017, 14(1):55-66.
免疫激活状态的特征是被激活的巨噬细胞或Kupffer细胞和自然杀伤T(NKT)细胞产生炎症介质,如干扰素(IFN)、IL-1β、IL-8和TNF。此外,中性粒细胞释放活性氧并形成中性粒细胞胞外陷阱(NETs)。为了诱导免疫抑制,APPs招募具有免疫抑制功能的单核细胞和中性粒细胞,称为髓源性抑制细胞(MDSCs),它们产生抗炎细胞因子,如IL-10和转化生长因子-β(TGF-β)。MDSCs还通过精氨酸酶-1、诱导型一氧化氮合酶(iNOS)和诱导调节性T细胞(Treg)抑制T细胞应答。
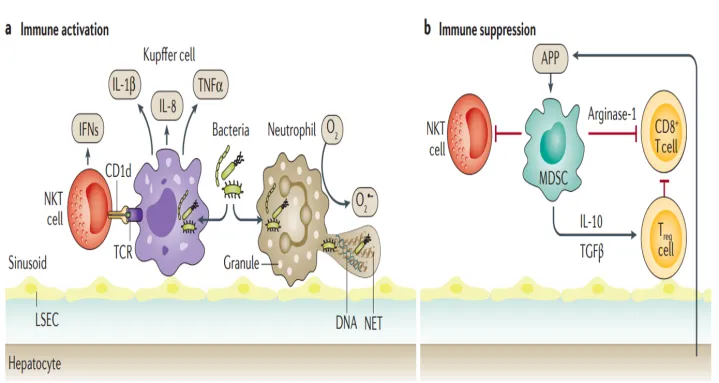
图源:Nat Rev Gastroenterol Hepatol, 2017, 14(1):55-66.
2. 临床表型
脓毒症肝损伤临床常见三种类型:缺氧性肝炎,胆汁淤积,继发性硬化性胆管炎(SSC)。
(1)缺氧性肝炎:缺氧肝炎常发生于入院后48小时内,这种情况是由低氧血症或低灌注引起,以血清天冬氨酸氨基转移酶(AST)和丙氨酸氨基转移酶(ALT)活性大幅增加为特征。重症患者缺氧性肝炎的发生率约为10%,院内病死率约为50%。
临床标准:呼吸或循环衰竭;血清氨基转移酶水平突然升高(通常>正常水平上限的20倍),并排除其他急性肝细胞坏死原因,如急性病毒性或药物性肝炎。预后不良因素包括:肝脏生物合成能力受损、脓毒症休克、血氨水平升高和转氨酶水平持续升高。
(2)胆汁淤积:缺氧性肝炎患者中约有1/3会发生胆汁淤积,但其发生机制目前尚未明确。可能的分子机制是炎症介导的肝细胞转运系统损伤、紧密连接断裂和细胞内生物转化减少。胆汁淤积多于入院后48小时内发生。严重感染如肺炎、革兰氏阴性菌脓毒症、心力衰竭、机械通气或药物是其危险因素。胆汁淤积和黄疸增加感染风险,包括(细菌易位、胃肠道并发症和肾衰竭),初发缺氧性肝炎和连续黄疸患者的1年死亡率为90%。
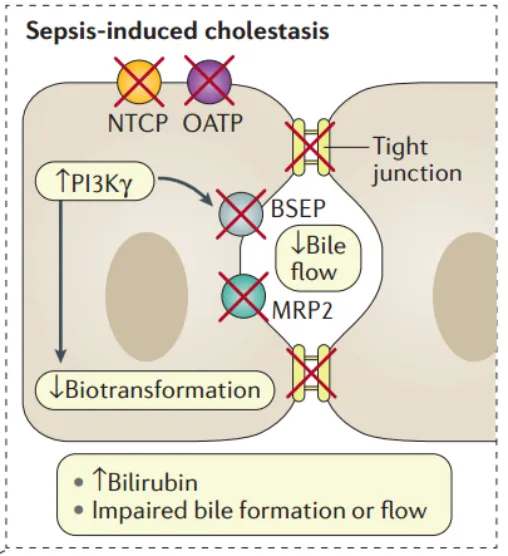
(3)继发性硬化性胆管炎(SSC):其临床特征是炎症、纤维化和胆管破坏。危险因素包括严重全身性低血压(严重休克时)、创伤或急性呼吸窘迫综合征(ARDS)和SIRS。SSC的发病与肝硬化的快速进展相关,危重患者的SSC导致胆道系统进行性炎症破坏,未进行肝移植的患者预后较差。
3. 治疗
脓毒症肝损伤的治疗主要是针对原发病的治疗,包括控制感染、早期液体复苏和应用血管活性药物。对于缺氧性肝炎,目前仍没有特异性的治疗药物。既往研究显示,如果在入ICU前使用他汀类药物,可能会降低危重症患者缺氧性肝炎的发生率。也有研究显示强化胰岛素治疗、控制血糖可以减少胆汁淤积的发生;此外,肠内营养也可以减少肝脏相关的代谢并发症。动物研究表明,皮质类固醇激素能够重建胆汁转运,具有免疫调节作用,但对于脓毒症休克患者,皮质类固醇激素是一把双刃剑,临床使用需权衡利弊。
展望
脓毒症的发病率和死亡率都非常高,早期诊断仍然非常重要,我们期待未来有更多的生物标志物以及生物标志物的联合使用,能够提高对脓毒症的早期诊断率。在治疗方面,除了原发病治疗,免疫治疗可能是未来的一个发展方向,现在研究较多的如干扰素-γ、GM-CSF、IL-7或PD1等,希望未来能够根据患者个人需求进行免疫调节治疗。同时也需要改进宿主反应监测,可以考虑使用转录组或代谢组分析,有助于指导免疫治疗。脓毒症患者远期生存质量较差,所以如何提高脓毒症患者出院后的远期生存质量也是未来研究的方向。
参考文献
[1] American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis[J]. Crit Care Med, 1992, 20(6):864-874.
[2] Levy M M, Fink M P, Marshall J C, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J]. Intensive Care Med, 2003, 29(4):530-538.
[3] Singer M, Deutschman C S, Seymour C W, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8):801-810.
[4] Huttunen R, Aittoniemi J. New concepts in the pathogenesis, diagnosis and treatment of bacteremia and sepsis[J]. J Infect, 2011, 63(6):407-419.
[5] Kramer L, Jordan B, Druml W, et al. Incidence and prognosis of early hepatic dysfunction in critically ill patients--a prospective multicenter study[J]. Crit Care Med, 2007, 35(4):1099-1104.
[6] Strnad P, Tacke F, Koch A, et al. Liver - guardian, modifier and target of sepsis[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(1):55-66.
[7] Lelubre C, Vincent J L. Mechanisms and treatment of organ failure in sepsis[J]. Nat Rev Nephrol, 2018, 14(7):417-427.
[8] Strnad P, Tacke F, Koch A, et al. Liver-guardian, modifier and target of sepsis[J]. Nat Rev Gastroenterol Hepatol, 2017, 14(1):55-66.
作者简介
高景
*本文根据“呼吸危重症菁英秀”第三期专题视频整理,感谢高景教授予以审核。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信