登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:蒋磊

ARDS的最佳液体容量策略仍存在着挑战和争议。因缺少强有力的事实依据,ATS/ESICM/SCCM未推荐明确的液体容量策略。BTS/JSRCM/JSICM较弱地推荐了保守的液体容量策略。
从下图可以发现,肺保护性通气和俯卧位通气在ARDS处理中的事实证据相当充足。目前很多专家及学术会议都较为倾向于保守性液体策略,但其事实证据仍然缺乏[1]。
研究发现,ECMO第3天的液体正平衡是患者90天病死率的一项独立预测因素[4]。
重症ARDS患者ECMO初始3天内的累积液体平衡是90天医院病死率独立危险因素[5]。
2021年CHEST年度会议摘要也提示我们,液体摄入增加与住院死亡率的小幅增加有关,统计学具有显著差异。
由下图可见,ARDS患者通常需要正压通气,而正压通气会导致胸腔内压的增加,进而激活压力感受器,造成水钠重吸收。充足的液体能够在正压通气情况下恢复右心前负荷。另外,在存在第三间隙液体弥散的情况下,充足的液体能够保证心输出量,还能维持血压和血流动力学稳定,同时也能够保证肾脏的充足灌注。但液体过负荷也具有相当大的危害,其能够增加肺泡和间质的渗出,在没有液体反应性的情况下,还会增加循环静脉淤血,包括肺静脉淤血及体循环淤血。此外,液体过负荷还可导致肺血管内皮的牵张力,使血管通透性进一步增加,还会导致肾皮质水肿[2]。
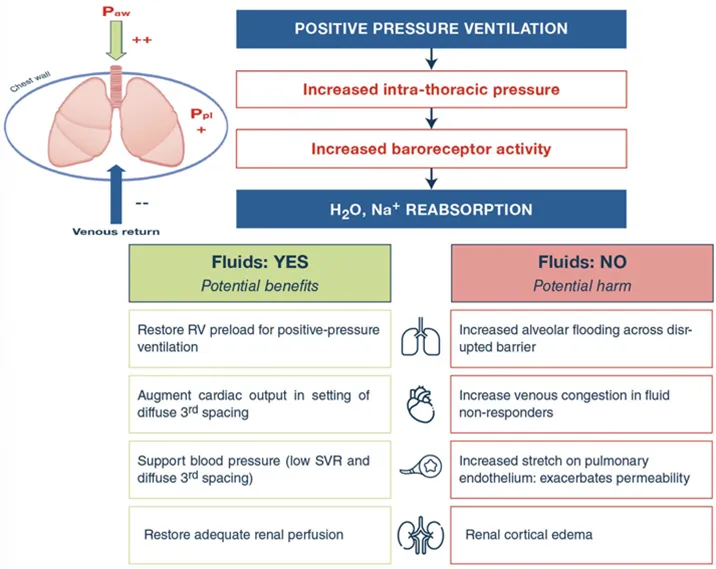
鉴于上述原因,对ARDS患者的容量管理原则包括:①减少液体在肺间质和肺泡腔的聚集;②维持足够的血容量;③保证肺外器官的灌注。

二、ARDS容量管理策略
1. 开放液体策略
2000年Rivers等提出早期目标导向治疗(early goal-directed therapy,EGDT)方案显著降低医院死亡率,即在脓毒症休克早期给患者进行大剂量容量复苏,能够降低病死率。2000—2007年相继发表的研究也发现EGDT能够改善患者的病死率。但2008—2014年发表的ProCESS研究、ARISE研究、ProMISe研究并未发现EGDT的益处。这些研究的参照组和EGDT组的容量水平相差不多,且高于既往EGDT组,通过这些研究我们也发现,EGDT早期容量复苏已经成为临床医生的诊疗共识[6,7]。
根据Frank-Starling曲线,在心肌顺应性不变的情况下,增加心室前负荷就能增加每搏量和心输出量,改善器官灌注及氧输送,它带来的负面影响是可能造成ARDS患者液体过负荷,使低氧血症进一步恶化,进而导致预后不良。
2. 保守液体策略
保守性液体策略的优势在于:①无合并休克时降低死亡率;②高炎症反应时降低死亡率。反之则增加患者病死率。
2006年的一项研究发现,保守性液体策略尽管不能改善60天死亡率,但能改善肺功能,缩短机械通气时间和住ICU时间,不增加肺外器官衰竭[8]。2007年一项meta分析显示,保守的液体策略可以减少住ICU时间和缩短机械通气时间,但在死亡率方面并没有显著获益[9]。
Ongoing OPTIFLUID研究主要目的在于评估脓毒性休克时,针对非复苏液体采取优化限制策略,降低液体平衡是否能改善患者预后。而正在进行的Ongoing CLOVERS研究旨在观察在脓毒症早期进行保守液体复苏是否能降低ARDS的形成风险。该研究设计是当脓毒症患者出现低血压,初始给予1~3 L晶体液后,如果低血压始终存在,开放液体组则以补液为主,限制液体组则以血管活性药物为主,24 h后采取常规治疗,并进一步观察这两种策略对患者预后的影响。
2021 Critical Care Medicine会议中有2篇文献摘要,其中一篇摘要显示COVID-19死亡率高的患者,其液体过多。另一篇摘要显示,过多的液体进入量,尤是在最初5天,能够改善患者存活率。在COVID-19流行的当下,我们仍需继续探究最佳的液体策略。
3. ARDS液体分期管理策略
ARDS早期常伴发休克或低血压,此时可以采取液体分期管理策略,即ROSE方案:复苏(Resuscitation)、优化(Optimization)、稳定(Stabilization)、脱水(Evacuation)。
复苏期是在1 h内快速补液,尽快复苏。随着液体的复苏,器官损伤水平降低。随后的几小时,液体管理进入优化期,此时需要进行滴定式补液,这一阶段,器官损伤可能会增加。第三阶段即稳定期,当血流动力学逐渐进入稳定期后,器官损伤并未改善。而进入脱水期,如果患者的血流动力学已经稳定,ARDS正在改善,原发病得到控制,这一阶段就需要将累积的液体进行脱水,之后器官损伤会逐渐下降,这一过程可能需要相对较长的一段时间。如果过度脱水,则可能对患者造成不良影响。
如果是单纯ARDS,在休克复苏期,需要采取最小剂量液体维持血流动力学稳定。在优化期,单纯ARDS继续保持保守性液体策略。如果合并休克,在复苏期,以补液恢复血流动力学为主要目标。对于是否在这一阶段限制液体输入,早期使用血管活性药,仍存在争议,需要更多研究来佐证。在优化期,补液需更加慎重,以维持器官灌注、限制肺功能恶化为主要目标。当血管活性药停用12 h以上,进入稳定脱水期,则以恢复液体平衡为主,可以使用利尿剂或利尿剂联合白蛋白。
4. ARDS合并休克时的容量策略
对于低血压或血乳酸水平>4 mmol/L,1 h的复苏方案推荐快速输注晶体液,以达到足够的灌注压,此时需要密切监测血流动力学变化和组织灌注,预测液体反应性。一旦血流动力学稳定,在复苏和优化阶段就应去除过多的液体来恢复液体平衡。
5. 单纯ARDS时的容量策略
对于单纯ARDS,早期液体处理的目标是抵消正压通气对血流动力学潜在的不良影响。气道正压促进液体正平衡,此时的气道压应尽量保持低水平。

三、纠正容量过负荷策略
纠正容量过负荷可采取的方法包括:①限制液体摄入:出现多尿期在临床较少见,除非患者从急性肾损伤恢复至多尿期;胸腔内压或气道正压较高,可能会促进钠水吸收,造成容量过负荷,此时采取低PEEP需要一定的条件,即ARDS患者氧合改善,肺部病变吸收。②利尿剂。③CRRT。
1. 利尿剂
东南大学附属中大医院重症团队对FACTT研究进行了再次分析,结果显示利尿剂与降低ARDS患者28天病死率具有相关性[10]。另一项研究也发现,在ARDS患者中,容量超负荷很常见,早期使用利尿剂与较低的住院死亡率独立相关[11]。
2. CRRT
ARDS(发生12 h内)早期行CRRT有利于容量管理、改善肺水肿和氧合、缩短机械通气时间。研究发现,在第7天,早期CRRT患者的氧合指数改善非常明显;另外,早期CRRT还能缩短CRRT的治疗时间[12]。
另有研究显示,ARDS患者启动CRRT最普遍的适应证是容量过负荷,其次是合并急性肾损伤,但该研究并未发现CRRT启动时机影响存活获益[13]。

四、小结

[1] Lee J, Corl K, Levy M M. Fluid Therapy and Acute Respiratory Distress Syndrome[J]. Crit Care Clin, 2021, 37(4):867-875.
[1] Lee J, Corl K, Levy M M. Fluid Therapy and Acute Respiratory Distress Syndrome[J]. Crit Care Clin, 2021, 37(4):867-875.
[2] Philippe P, Evrard B, Asfar P, et al. Fluid administration and monitoring in ARDS: which management?[J]. Intensive Care Med, 2020, 46(12):2252-2264.
[3] Niedermeyer S E, Stephens R S, Kim B S, et al. Calculated Plasma Volume Status Is Associated With Mortality in Acute Respiratory Distress Syndrome[J]. Crit Care Explor, 2021, 3(9):e0534.
[4] Schmidt M, Bailey M, Kelly J, et al. Impact of fluid balance on outcome of adult patients treated with extracorporeal membrane oxygenation[J]. Intensive Care Med, 2014, 40(9):1256-1266.
[5 ]Chiu L C, Chuang L P, SLin S W, et al. Comparisons of Outcomes between Patients with Direct and Indirect Acute Respiratory Distress Syndrome Receiving Extracorporeal Membrane Oxygenation[J]. Membranes (Basel), 2021, 11(8):644.
[6] Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock[J]. N Engl J Med, 2001, 345(19):1368-1377.
[7] Self W H, Semler M W, Bellomo R, et al. Liberal Versus Restrictive Intravenous Fluid Therapy for Early Septic Shock: Rationale for a Randomized Trial[J]. Ann Emerg Med, 2018, 72(4):457-466.
[8] National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network, Wiedemann H P, Wheeler A P, et al. Comparison of two fluid-management strategies in acute lung injury[J]. N Engl J Med, 2006, 354(24):2564-2675.
[9] Silversides J A, Major E, Ferguson A J, et al. Conservative fluid management or deresuscitation for patients with sepsis or acute respiratory distress syndrome following the resuscitation phase of critical illness: a systematic review and meta-analysis[J]. Intensive Care Med, 2017, 43(2):155-170.
[10] Zhang R, Chen H, Gao Z, et al. The Effect of Loop Diuretics on 28-Day Mortality in Patients With Acute Respiratory Distress Syndrome[J]. Front Med (Lausanne), 2021, 8:740675.
[11] Seitz K P, Caldwell E S, Hough C L. Fluid management in ARDS: an evaluation of current practice and the association between early diuretic use and hospital mortality[J]. J Intensive Care, 2020, 8:78.
[12] Han F, Sun R, Ni Y, et al. Early initiation of continuous renal replacement therapy improves clinical outcomes in patients with acute respiratory distress syndrome[J]. Am J Med Sci, 2015, 349(3):199-205.
[13] Dill J, Bixby B, Ateeli H, et al. Renal replacement therapy in patients with acute respiratory distress syndrome: a single-center retrospective study[J]. Int J Nephrol Renovasc Dis, 2018, 11:249-257.

 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信