登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
01
02
在ARDS患者有创通气的气道管理中,需要保持通气管路的畅通,保障通气及CO2的排出;维持气道/肺泡压力,持续压力可诱导肺复张;保证肺通气的均一性,改善通气血流比例,减少剪切伤;同时还要关注人机协调、气道廓清、早期肺康复、拔管的评估/保障/实施等。我们需要关注机械通气下肺部微生态变化,肺部微生态主要是上呼吸道微生物与宿主防御清除平衡的结果,肠道微生物群的迁移也会直接或间接影响肺部微生态[8]。
气道上皮细胞被感染后,往往出现气道上皮纤毛清除黏液功能下降,免疫屏障功能减弱,气道上皮细胞招募免疫细胞,气道内细胞群落协同维持肺内免疫稳态。一旦稳态失衡,则会导致严重后果[9]。
临床上,一般从型号、压力、容量、声门下吸引几个方面考虑来选择气管插管,同时需要关注气道阻力、气道密闭性、气道侧壁压力以及气道分泌物清除情况。目前临床多使用高容低压的插管,尤其是声门下吸引,会明显降低口腔分泌物对下呼吸道微生态的影响。
气管插管的日常管理主要包括:①漏气确认-听诊/锯齿波/Vti-e;②气囊压力检测的方法和频度;③过高的气囊压力会导致气管黏膜压迫/微循环障碍、局部黏膜纤毛功能受损、甚至气管食管瘘,最终导致预后不良;球囊压力设置为20~30/25~30 cmH2O[10]。
低温对纤毛搏动频率和黏液传输速度有一定的影响。动物实验将绵羊气管切开置于气管浴缸内,用含分束器的解剖显微镜观察上皮细胞,当上皮温度从37°C降至30°C,黏液传输速度和纤毛搏动频率在4 h内迅速下降,黏液纤毛功能均完全丧失;当上皮温度从37°C降至34°C,出现类似而较慢的改变。研究得出结论:在100%相对湿度下,30°C与34°C加温不足以维持呼吸道上皮功能[11]。
黏液纤毛的输送能力也随温度/湿度的变化而快速变化。动物模型的气道黏膜暴露于室内气流时,黏液传输速度在(2.0±0.4)s内减慢至(0.1±0.1)mm/min,随后,纤毛搏动频率在(2.3±0.8)s后下降至(6.7±1.9)Hz,当重新引入加温加湿气流时,黏液传输速度和纤毛搏动频率均恢复到初始状态。此外,黏膜运输的速度改变比平常认为的要快很多,因此需要强调加温加湿的重要性[12]。
气管插管管路加温加湿有各种系统,包括双加热导丝管路以及温度反馈系统,这种管路有一定的优势,例如无管路积水,整个管路的阻力会更低。需要注意的是,此种管路最后一段的蛇形管没有加热导丝,所以有时此处会有积水,并且会有一部分无效腔通气。临床中需要关注这一问题。
气管内分泌物增加会明显增加气道阻力,下图可以看到内径的明显变化[13],即使每天清理,甚至利用纤支镜处理,依然会存在此种问题。2010年美国呼吸病协会发布了关于人工气道机械通气患者气管内吸痰的临床实践指南[14],指南建议:①仅在有分泌物的情况下进行气管内吸痰,而不是常规吸痰;②如果患者临床上有明显的血氧饱和度降低,应考虑预氧合;③在不断开患者与呼吸机连接的情况下进行吸痰;④不要在吸痰前常规使用生理盐水;⑤对有高FiO2、PEEP或有吸痰导致肺不张危险的成人和新生儿,使用闭式吸引;⑥使用吸引管,使儿童和成人气管管腔闭塞不超过50%,婴儿不超过70%;⑦吸痰持续时间控制在15 s以内。
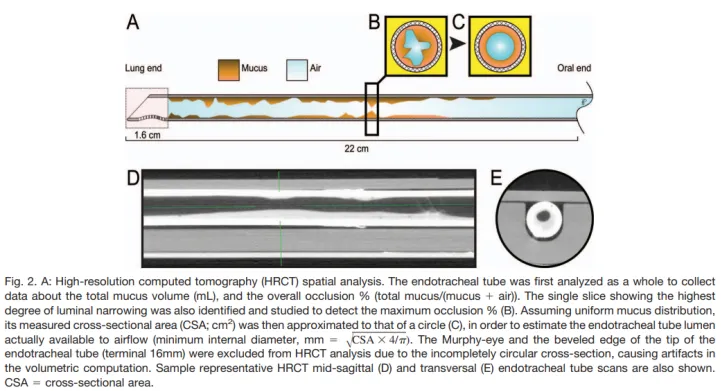
图源:Respir Care, 2016, 61(11):1431-1439.
03
雾化吸入的作用主要是稀释痰液,保护气道黏膜和纤毛的功能。我们在日常工作中会利用筛孔雾化器吸入噬菌体,进而降低患者体内病原体的载量,另外还会进行环境喷洒,降低病原体感染风险。
无菌技术操作是气道管理的重要环节。诊疗护理操作过程中必须严格遵守无菌技术操作规程,特别是实施气管切开、气管插管、吸痰及断开呼吸管路等操作时,应避免污染,以降低感染的风险。
在气管切开、气管插管及吸痰过程中,小气道的管理也非常重要。我们在新冠病毒感染患者中使用了ACAPELLA,利用正压震荡来促进气道分泌物排出,有利于小气道的廓清及开放,能够获得较好的效果。
综上,气道管理需要贯穿ARDS治疗的全过程,并要遵循评估-干预-再评估的个体化治疗方案,重视呼吸参数的调节及监控。气道管理是一个系统工程,细节与团队协作是成功的基础。

[1] Grieco D L, Maggiore S M, Roca O, et al. Non-invasive ventilatory support and high-flow nasal oxygen as first-line treatment of acute hypoxemic respiratory failure and ARDS[J]. Intensive Care Med, 2021, 47(8):851-866.
[2] Oppersma E, Doorduin J, van der Heijden E H, et al. Noninvasive ventilation and the upper airway: should we pay more attention?[J]. Crit Care, 2013, 17(6):245.
[3] Grieco D L, Maggiore S M, Roca O, et al. Non-invasive ventilatory support and high-flow nasal oxygen as first-line treatment of acute hypoxemic respiratory failure and ARDS[J]. Intensive Care Med, 2021, 47(8):851-866.
[4] Ding L, Wang L, Ma W, et al. Efficacy and safety of early prone positioning combined with HFNC or NIV in moderate to severe ARDS: a multi-center prospective cohort study[J]. Crit Care, 2020, 24(1):28.
[5] Ehrmann S, Li J, Ibarra-Estrada M, et al. Awake prone positioning for COVID-19 acute hypoxaemic respiratory failure: a randomised, controlled, multinational, open-label meta-trial[J]. Lancet Respir Med, 2021, 9(12):1387-1395.
[6] Bellani G, Laffey J G, Pham T, et al. Noninvasive Ventilation of Patients with Acute Respiratory Distress Syndrome. Insights from the LUNG SAFE Study[J]. Am J Respir Crit Care Med, 2017, 195(1):67-77.
[7] De Jong A, Citerio G, Jaber S. Focus on ventilation and airway management in the ICU[J]. Intensive Care Med, 2017, 43(12):1912-1915.
[8] Fromentin M, Ricard J D, Roux D. Respiratory microbiome in mechanically ventilated patients: a narrative review[J]. Intensive Care Med, 2021, 47(3):292-306.
[9] Hewitt R J, Lloyd C M. Regulation of immune responses by the airway epithelial cell landscape[J]. Nat Rev Immunol, 2021, 21(6):347-362.
[10] Klompas M, Branson R, Eichenwald E C, et al. Strategies to prevent ventilator-associated pneumonia in acute care hospitals: 2014 update[J]. Infect Control Hosp Epidemiol, 2014, 35 Suppl 2:S133-154.
[11] Kilgour E, Rankin N, Ryan S, et al. Mucociliary function deteriorates in the clinical range of inspired air temperature and humidity[J]. Intensive Care Med, 2004, 30(7):1491-1494.
[12] Kelly S J, Martinsen P, Tatkov S. Rapid changes in mucociliary transport in the tracheal epithelium caused by unconditioned room air or nebulized hypertonic saline and mannitol are not determined by frequency of beating cilia[J]. Intensive Care Med Exp, 2021, 9(1):8.
[13] Pinciroli R, Mietto C, Piriyapatsom A, et al. Endotracheal Tubes Cleaned With a Novel Mechanism for Secretion Removal: A Randomized Controlled Clinical Study[J]. Respir Care, 2016, 61(11):1431-1439.
[14] American Association for Respiratory Care. AARC Clinical Practice Guidelines. Endotracheal suctioning of mechanically ventilated patients with artificial airways 2010[J]. Respir Care, 2010, 55(6):758-764.
[15] Ntoumenopoulos G, Berry M P, Camporota L, et al. Indicators of Airway Secretion Weight in Mechanically Ventilated Subjects[J]. Respir Care, 2019, 64(11):1377-1386.
[16] Lacherade J C, De Jonghe B, Guezennec P, et al. Intermittent subglottic secretion drainage and ventilator-associated pneumonia: a multicenter trial[J]. Am J Respir Crit Care Med, 2010, 182(7):910-917.
[17] Raimundo R D, Sato M A, da Silva T D, et al. Open and Closed Endotracheal Suction Systems Divergently Affect Pulmonary Function in Mechanically Ventilated Subjects[J]. Respir Care, 2021, 66(5):785-792.
上海市(复旦大学附属)公共卫生临床中心呼吸与重症医学科 副主任医师
中华医学会结核病学分会重症专业委员会常务委员
上海市中西医结合学会传染病专业委员会委员
上海市中医药学会第十一届肺系病分会委员
复旦大学抗疫先进个人
发表SCI及核心期刊论文10余篇
参与主持市区级课题多项
获国家实用新型专利1项
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信