登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:徐婷,林勇
一、病例
患者女性,57岁,退休会计,因“间断性发热伴咳嗽2年余,再发伴胸闷5天”于2017年11月9日入院。患者2年内无明显诱因出现反复发热3次,急性起病,伴流涕、咳嗽、胸闷、活动后气喘,查体见口唇发绀,双肺闻及少许湿啰音,血气分析提示Ⅰ型呼吸衰竭,需吸氧,无创/有创机械通气治疗,对抗生素应答不佳,静脉应用糖皮质激素后症状可在5~7 d内迅速好转。末次起病时胸部CT如图1所示。
二、变应性真菌性气道疾病
“真菌、环境因素、宿主免疫状态”在真菌所致肺部疾病中是一个永恒的三角。根据宿主的免疫状态不同,真菌相关气道疾病有不同的表现形式(图5)。当非过敏因素参与时,根据患者的基础疾病状态(如慢阻肺、支气管扩张、结节病、结核等),可表现为曲霉性支气管炎、慢性肺曲霉病、肺曲霉球以及血管侵袭性真菌病。而患者存在免疫异常,超敏状态(如合并哮喘、慢性肉芽肿病、高IgE综合征、囊性纤维化等)时,在高真菌暴露负担下,常表现为真菌致敏,即变应性真菌性气道疾病(allergic fungal airways disease,AFAD)[3]。
图6 根据宿主的免疫状态不同,肺部真菌病有不同的表现形式
高分辨率CT(HRCT)的表现虽无明显特异性,但依然有蛛丝马迹可以辅助诊断,如高衰减黏液栓、中央或近端支气管扩张是ABPA的诊断标准,AFAD常有上叶纤维化,伴有重度不可逆的气流受限,HRCT可发现轻度支气管扩张,常见于重症哮喘和慢阻肺患者,而树芽征和结节在AFAD患者中相对常见。
暴露在高水平真菌孢子环境中(如园艺工作)可导致真菌性肺炎,出现急性呼吸系统疾病伴肺部阴影,其典型表现为:痰液中大量真菌生长,三唑类抗真菌药物疗效良好,但真菌性支气管炎患者的真菌相关IgE水平可不升高[5]。
2024年国际人类与动物真菌学会(ISHAM)指南对真菌致敏性评估做出了如下建议[7]:并非所有的真菌都需评估致敏性,建议对烟曲霉的致敏性进行评估(level of consensus,LoC:94.9%);在难治性哮喘患者烟曲霉致敏阴性时,评估其他真菌的致敏性(LoC:61.5%);哮喘患者的真菌致敏性评估选用真菌特异性IgE优于皮肤点刺试验记录(LoC:76.5%);建议在三级医疗机构中对所有新诊断的成人哮喘患者进行曲霉致敏性评估(LoC:71.4%);建议仅在难治性儿童哮喘患者中评估曲霉致敏性(LoC:73.0%)。但对于第一次筛查时阴性的患者进行烟曲霉致敏筛查的周期并无推荐。
AFAD的临床类型包括难治性哮喘(真菌致敏的严重哮喘,severe asthma with fungal sensitization,SAFS)和极少数慢阻肺,ABPA/ABPM,变应性真菌性鼻-鼻窦炎(allergic fungal rhinosinusitis,AFRS),慢性嗜酸细胞性支气管炎/肺炎,肺叶萎陷(黏液栓塞所致),后期固定气流阻塞,支气管扩张和上叶纤维化,持续性痰液分泌(真菌性支气管炎),真菌性脓胸以及原因不明的外周血嗜酸性粒细胞增多或总IgE>1000 IU/L[3]。
真菌是过敏性哮喘重要的诱发及加重因素之一[8]。哮喘规范化治疗后仍有多达20%的患者控制效果欠佳,其中1/3~1/2的患者系真菌过敏。哮喘症状、严重程度、死亡率和住院率与空气中真菌孢子的数量及室内真菌的暴露相关[9],皮肤真菌过敏原测试阳性和真菌过敏现象在重症哮喘中更常见[10]。有研究显示哮喘患者的住院次数与患者的真菌致敏率密切相关,与轻度哮喘患者相比,严重哮喘组(多次入院)所有真菌过敏原皮肤测试呈阳性的情况更为常见。多次入院患者中有3/4对霉菌过敏,其中50%对多种霉菌过敏原呈阳性,曲霉37%,链格孢属26%,分枝孢霉属41%,青霉属30%,念珠菌属33%[11]。如果哮喘患者对真菌抗原敏感,称为真菌致敏性哮喘(AAFS)。伴SAFS与2型免疫反应增强密切相关,真菌孢子及其产物与上皮细胞上的受体结合,活化的上皮细胞释放负责Th2细胞招募的细胞因子和生长因子,Th2细胞因子也可以通过改变细胞外基质来诱导气道重塑,形成牵拉性支气管扩张和纤维化。
SAFS的诊断标准如下:①难以控制的严重哮喘和喘息,即严重哮喘和慢阻肺在常规治疗下,同时应用大剂量的静脉或吸入糖皮质激素和长效β2受体激动剂仍无法控制或需要使用大剂量糖皮质激素;②真菌过敏,真菌皮肤点刺试验阳性和皮内试验阳性,或真菌抗原特异性的血清IgE阳性;③未达到ABPA的诊断标准;④痰液中真菌生长或检测到真菌菌丝[12]。对于哮喘伴曲霉致敏患者,建议检查血清总IgE(LoC:89.7%),特异性烟曲霉IgG(LoC:82.1%)及外周血嗜酸性粒细胞计数(LoC:87.2%)[7]。
图7 与真菌过敏相关的哮喘进展史
表1 ABPM的影像学表现[19]
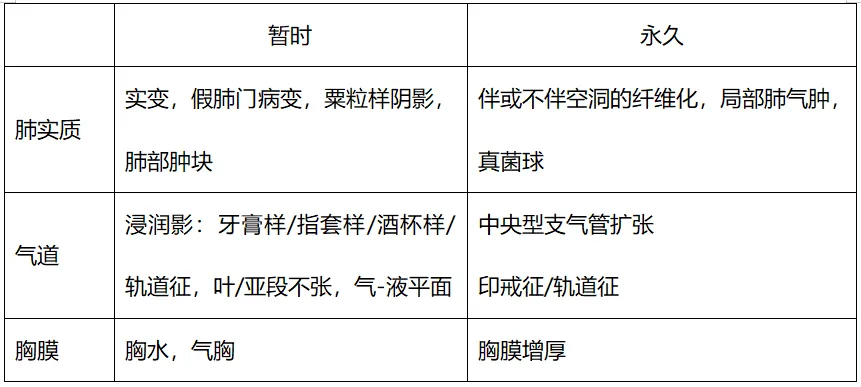
综上,真菌在呼吸道存在致病与致敏的二元性,真菌抗原既能引起AFRS,也可能引起ABPA。在临床中应仔细甄别,切莫忽视真菌致敏相关气道疾病。
参考文献
[1] Denning DW, Chakrabarti A. Pulmonary and sinus fungal diseases in non-immunocompromised patients[J]. Lancet Infect Dis, 2017, 17(11):e357-e366.
[2] Schuyler M, Cormier Y. The diagnosis of hypersensitivity pneumonitis[J]. Chest, 1997, 111(3):534-536.
[3] Wardlaw AJ, Rick EM, Pur Ozyigit L, et al. New Perspectives in the Diagnosis and Management of Allergic Fungal Airway Disease[J]. J Asthma Allergy, 2021, 14:557-573.
[4] Crameri R, Garbani M, Rhyner C, et al. Fungi: the neglected allergenic sources[J]. Allergy, 2014, 69(2):176-185.
[5] Woolnough K, Fairs A, Pashley CH, et al. Allergic fungal airway disease: pathophysiologic and diagnostic considerations[J]. Curr Opin Pulm Med, 2015, 21(1):39-47.
[6] Kosmidis C, Denning DW. The clinical spectrum of pulmonary aspergillosis[J]. Thorax, 2015, 70(3):270-277.
[7] Agarwal R, Sehgal IS, Muthu V, et al. Revised ISHAM-ABPA working group clinical practice guidelines for diagnosing, classifying and treating allergic bronchopulmonary aspergillosis/mycoses[J]. Eur Respir J, 2024, 63(4):2400061.
[8] Ghosh S, Hoselton SA, Dorsam GP, et al. Eosinophils in fungus-associated allergic pulmonary disease[J]. Front Pharmacol, 2013, 4: 8.
[9] Knutsen AP, Bush RK, Demain JG, et al. Fungi and allergic lower respiratory tract diseases[J]. J Allergy Clin Immunol, 2012, 129(2):280-291; quiz 292-3.
[10] Newson R, Strachan D, Corden J, et al. Fungal and other spore counts as predictors of admissions for asthma in the Trent region[J]. Occup Environ Med, 2000, 57(11):786-792.
[11] O'Driscoll BR, Hopkinson LC, Denning DW. Mold sensitization is common amongst patients with severe asthma requiring multiple hospital admissions[J]. BMC Pulm Med, 2005, 5:4.
[12] Fukutomi Y, Tanimoto H, Yasueda H, et al. Serological diagnosis of allergic bronchopulmonary mycosis: Progress and challenges[J]. Allergol Int, 2016, 65(1):30-36.
[13] Tiwary M, Samarasinghe AE. Initiation and Pathogenesis of Severe Asthma with Fungal Sensitization[J]. Cells, 2021, 10(4):913.
[14] Mirsadraee M, Dehghan S, Ghaffari S, et al. Long-term effect of antifungal therapy for the treatment of severe resistant asthma: an active comparator clinical trial[J]. Curr Med Mycol, 2019, 5(4):1-7.
[15] Parulekar AD, Diamant Z, Hanania NA. Antifungals in severe asthma[J]. Curr Opin Pulm Med, 2015, 21(1):48-54.
[16] Jones TL, Neville DM, Chauhan AJ. Diagnosis and treatment of severe asthma: a phenotype-based approach[J]. Clin Med (Lond), 2018, 18(Suppl 2): s36-s40.
[17] 中华医学会呼吸病学分会哮喘学组. 变应性支气管肺曲霉病诊治专家共识(2022年修订版)[J]. 中华结核和呼吸杂志, 2022, 45(12):1169-1179.
[18] Chowdhary A, Agarwal K, Kathuria S, et al. Allergic bronchopulmonary mycosis due to fungi other than Aspergillus: a global overview[J]. Crit Rev Microbiol, 2014, 40(1):30-48.
[19] Chowdhary A, Rhandhawa HS, Prakash A, et al. Environmental prevalence of Cryptococcus neoformans and Cryptococcus gattii in India: an update[J]. Crit Rev Microbiol, 2012, 38(1):1-16.
[20] Araujo R, Rodrigues AG. Variability of germinative potential among pathogenic species of Aspergillus[J]. J Clin Microbiol, 2004, 42(9):4335-4337.
[21] Imtiaj A, Jayasinghe C, Lee GW, et al. Physicochemical Requirement for the Vegetative Growth of Schizophyllum commune Collected from Different Ecological Origins[J]. Mycobiology, 2008, 36(1):34-39.
[22] Agarwal R. What is the current place of azoles in allergic bronchopulmonary aspergillosis and severe asthma with fungal sensitization[J]. Expert Rev Respir Med, 2012, 6(4):363-371.
[23] 赵兴泉, 钟渠, 顾珊珊, 等. 变应性真菌性鼻-鼻窦炎病原菌分布及炎症因子表达[J]. 中华医院感染学杂志, 2022, 32(8):1176-1179.
[24] 古庆家, 李静娴, 樊建刚, 等. 变应性真菌性鼻窦炎的诊断和治疗[J]. 中国耳鼻咽喉颅底外科杂志, 2020, 26(5):517-521.
[25]Barac A, Ong D, Jovancevic L, et al. Fungi-Induced Upper and Lower Respiratory Tract Allergic Diseases: One Entity[J]. Front Microbiol, 2018, 9:583.
作者简介

现任南京市胸科医院呼吸二科教学秘书
江苏省医学会呼吸分会感染学组成员
南京市“五一创新能手”
江苏省南京市“十三五”卫生青年人才
中国防痨协会MDT分会委员
南京市健康教育岗位能手
南京地区住培优秀指导医师
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信