登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:周庆涛
单位:北京大学第三医院呼吸与危重症医学科
进入21世纪,各种病毒感染不断暴发,呼吸道病毒威胁着人类健康。2003年,SARS,全球共确诊8098例,774人死亡;2009年,新型甲型H1N1流感,导致全球15.17万~57.54万人死亡;2012年,MERS,平均每10例患者中有3~4例死亡;2014年,埃博拉病毒感染,致死率达50%;2019年,COVID-19,全球近7亿人确诊,近700万患者死亡;2023年,流感病毒感染,CDC估计有至少2600万例感染患者、29万人住院、1.8万流感死亡病例。

新冠疫情结束之后,急性呼吸道疾病大反弹,2023年冬全球流感非常严重。超过50%的重症流感患者在入住ICU 7天后进展为侵袭性肺真菌病,其中流感病毒相关侵袭性肺曲霉病(IAPA)高发。流感通过诱发的局部免疫失调来增加机体对侵袭性肺曲霉病(IPA)的易感性,IAPA好发于SOT、血液恶性肿瘤等免疫功能严重低下患者,发病率为9%,病死率达60%。呼吸道病毒合并霉菌感染问题日益严峻。

CAPA发病率因国家而异,中欧和亚洲国家最高(21%~31.4%),其次为英国、西班牙、南欧和北美国家(<10%)。研究表明,CAPA患者病死率为43%~90%,显著高于未合并侵袭性曲霉感染的COVID-19患者(P<0.05)。重症COVID-19患者并发CAM的比率约为1%,且与疫情前相比,近年来毛霉病发病率显著增加。毛霉病病情严重、进展迅速、临床预后差;若未及时治疗,毛霉病患者病死率可达90%以上。
研究显示,与非IAPA患者相比,IAPA患者在ICU内的住院时间相对更长。IAPA患者接受机械通气和连续性肾脏替代治疗(CRRT)治疗的比例更高,其ICU内病死率及30天病死率均为60%,显著高于非IAPA患者。
在非免疫功能缺陷IPA患者中,仅28.9%的患者早期表现为血管侵袭症状,且几乎所有患者在疾病开始时都表现出气道侵袭症状。与血液病患者不同,G试验和GM试验在诊断非血液病患者IA时的敏感性和阳性预测值相对较低。
抗真菌药物使用量增加导致IFD的流行病学转向耐药真菌感染。一项回顾性研究显示:在CAPA患者中,9%对两性霉素B耐药,3.6%对伊曲康唑耐药;且每10例CAPA患者中就有1例携带耐药菌株。临床中,耐药真菌感染关注度不足,从而导致患者常接受不适当的药物治疗,影响患者预后,唑类耐药曲霉感染患者病死率为47%~100%。

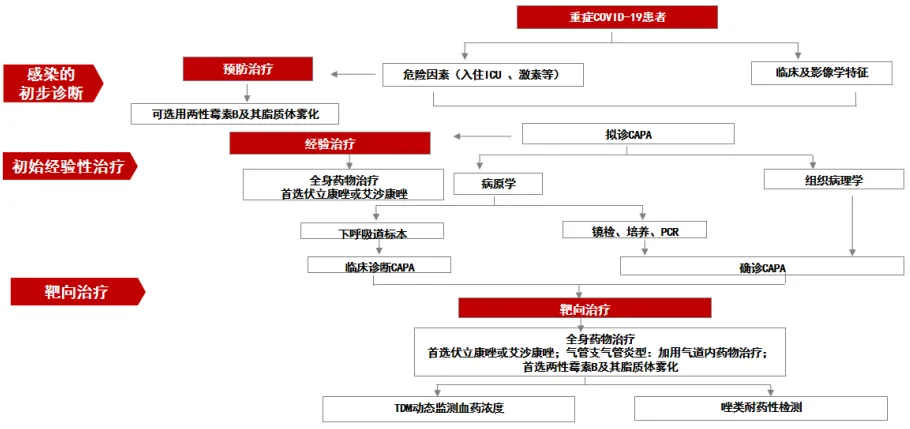
图1 CAPA诊疗流程图
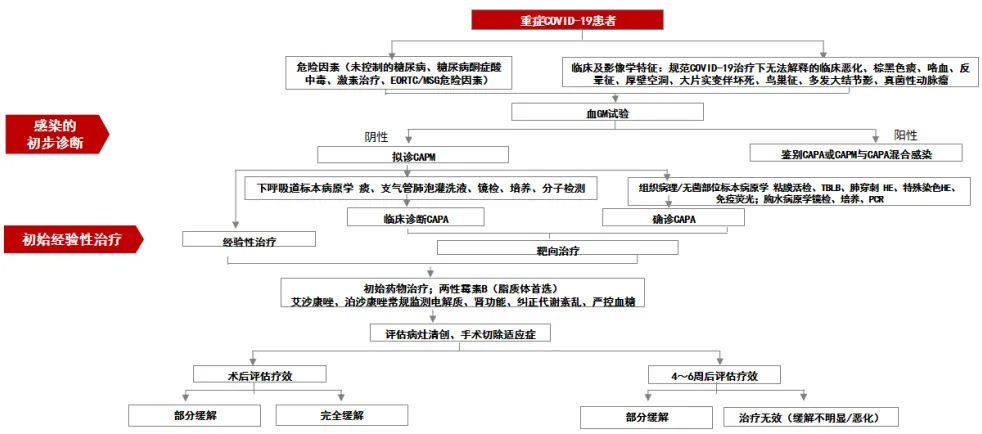
图2 CAPM诊疗流程图
参考文献
作者介绍
北京大学第三医院危重医学科主任、呼吸与危重症医学科副主任。主要研究领域:呼吸危重症。中国医师协会呼吸医师分会危重症医学工作委员会副主任委员,中华医学会呼吸病学分会呼吸危重症学组委员,中国医学装备协会呼吸病学装备专业委员会委员,中国老年学和老年医学学会老年呼吸与危重症医学分会常委,北京医学会重症医学分会委员。长期从事呼吸与危重症医学的临床、教学和科研工作,在呼吸系统常见病诊治和危重症救治方面积累了丰富经验。围绕重症感染与脓毒症、ARDS、呼吸治疗等进行了深入研究。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信