登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:张洁
单位:广州医科大学附属第一医院 广州呼吸健康研究院 重症医学科
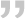

2023年4月体外生命支持组织(Extracorporeal Life Support Organization, ELSO)公布的全球ECMO中心的数量由1990年的83家增长到2023年的570家,在新冠疫情期间ECMO中心数量一度突破600家;每年ECMO病例数量在2023年已经接近19000例。ECMO中心以及每年的ECMO病例数量呈增长态势。然而,接受ECMO支持的成人患者,ECMO期间的存活率只有43%~66%,而出院存活率仅有31%~60%。由此可见,接受ECMO支持患者的生存预后还有较大的提升空间,我们需要从多方面做出努力,尤其应优化ECMO管理的各个环节。重症超声是ECMO管理中的重要辅助手段之一。2015年ELSO发布了重症超声在ECMO中的引导作用的指南,2018年之后,相关指南都被集中收录于ELSO发布的红宝书中。在2022年发布的第六版红宝书中,专门有一章节介绍超声对ECMO的辅助作用。
在1980年之前,ICU中患者的超声检查是由非ICU的医务人员完成的;而在1990年之后,即ELSO成立后,ICU专业人员开始系统学习重症超声的基本知识,并且经过各级培训,目前已经进入了标准化培训阶段。所以,重症超声是ICU入门的重要武器。2019年有学者回顾了重症超声的发展历程,文章特别强调,对于ECMO患者,重症超声发挥了非常关键的作用。目前国内外也发表了多部有关重症超声的指南共识,我国在2022年发布了《床旁即时超声在成人体外膜肺氧合管理中的应用中国专家共识》,2023年12月出版了《ECMO:重症超声可视化管理》。2024年5月发表的《重症超声在重症相关操作中应用专家共识》,其中有一部分内容专门提及了超声在ECMO置管中的应用。2024年5月,Intensive Care Med 杂志发表了一篇高质量综述(Head-to-toe bedside ultrasound for adult patients on extracorporeal membrane oxygenation),详细阐述了重症超声对ECMO的辅助作用。

重症超声参与了ECMO启动前、置管、运行、撤机拔管后的全部过程。在这些环节中,除了心脏超声,我们也会用到肺部超声、血管超声以及颅脑超声。
对于以呼吸困难为表现的急性呼吸衰竭患者,可以通过BLUE方案鉴别病因;对于休克患者,可以通过RUSH方案快速鉴别;对于心跳骤停患者,可以通过FEEL流程进行筛查。通过这些流程化的筛查基本上可以判断患者是否具有ECMO指征,同时筛查出部分可能快速解除的病因(如心包填塞、气胸、大量胸腔积液等)进行及时处理,从而避免不必要的ECMO治疗。此外,还可以排查一些VA-ECMO的禁忌证,例如主动脉夹层、主动脉瓣重度关闭不全。如下所示为急性呼吸衰竭、严重二尖瓣狭窄患者,此类患者不需VV-ECMO。对于心源性休克患者,经过超声评估发现是主动脉夹层(图1),这是VA-ECMO的禁忌证。
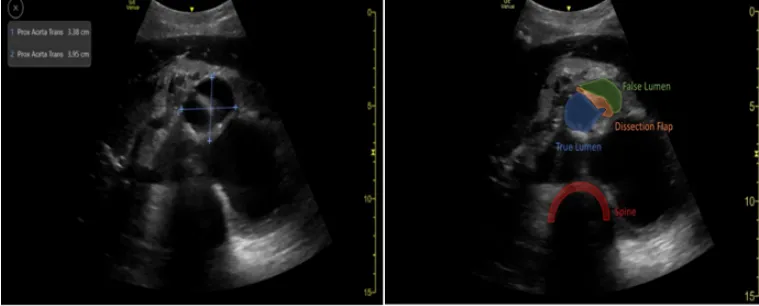
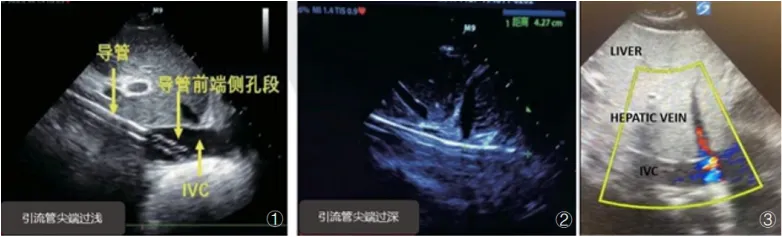
表1 ECMO运行期间床旁即时超声每日主要评估的内容
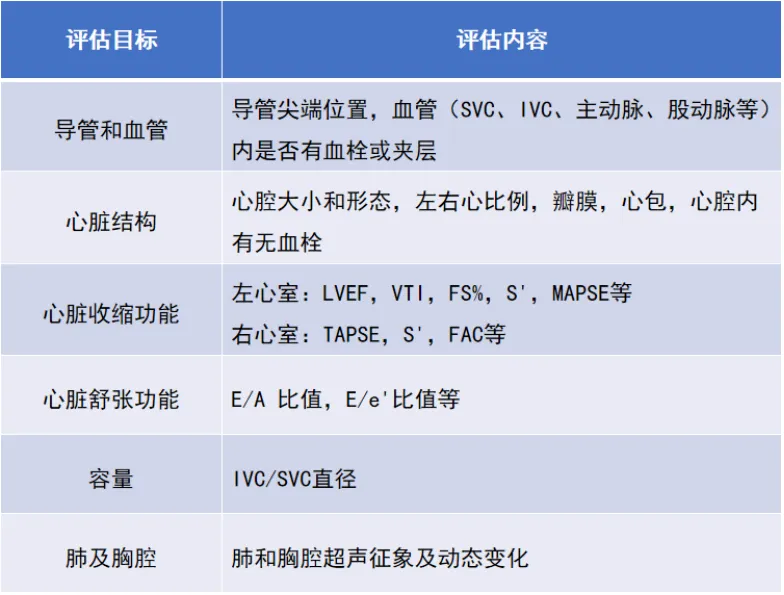
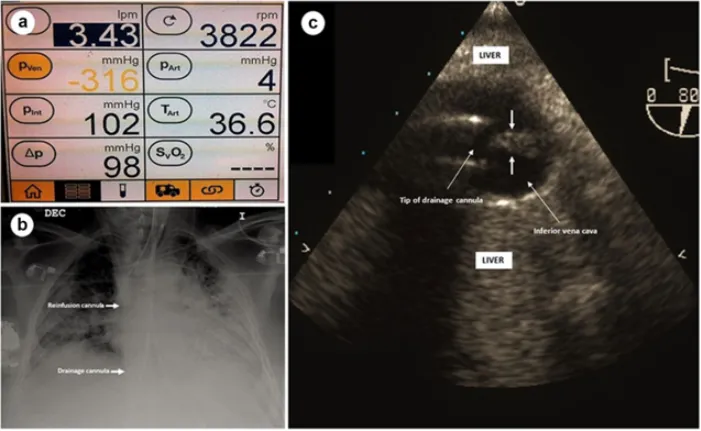
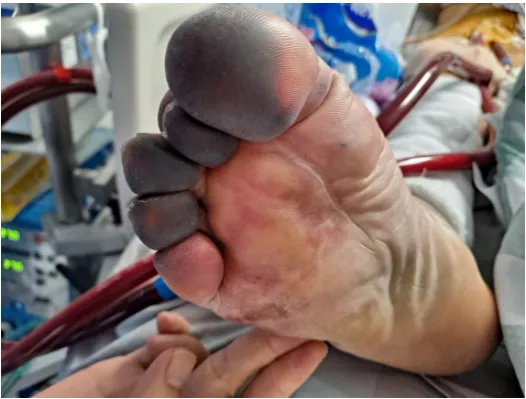
图4 ECMO微循环相关并发症
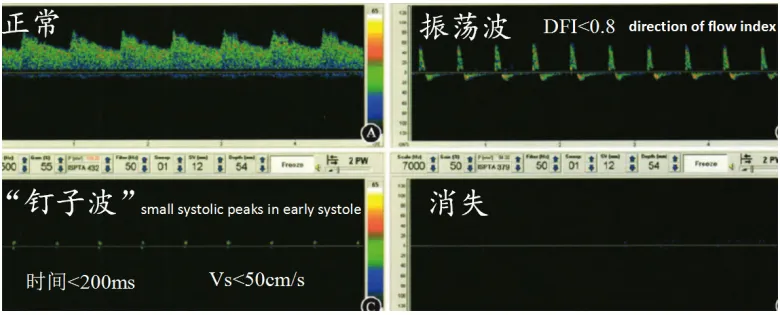
图5 经颅多普勒评估脑死亡

图6 视神经鞘的监测
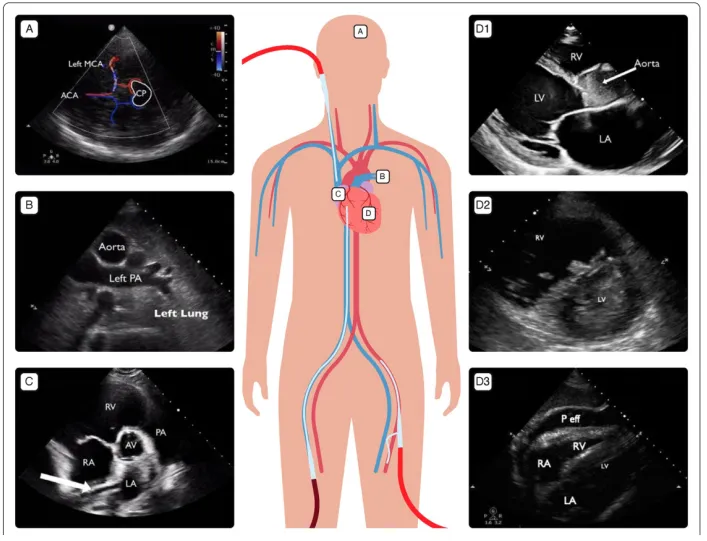
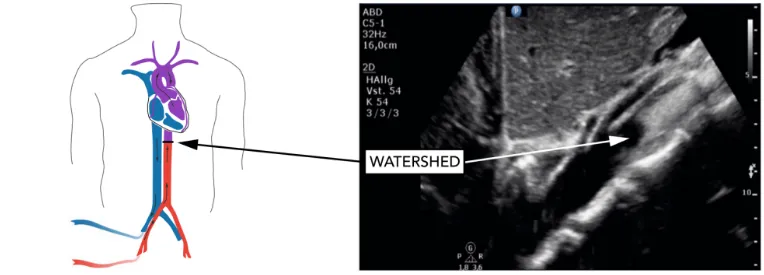
图8 超声造影发现外周VA-ECMO的交汇平面位于肠系膜上动脉远端(白色箭头所指)
综上,重症超声在ECMO全程能够发挥重要的辅助作用。ECMO启动之前,超声的主要作用在于诊断、排查禁忌证、ECMO模式选择以及确定管道尺寸。在ECMO置管过程中,超声能够引导穿刺、定位导管位置。在ECMO运行中,超声辅助原发病的评估、并发症的排查和撤机前评估。在ECMO撤机拔管后,利用超声评估血管并发症。在上述过程中,我们用到了心脏超声、血管超声、肺部超声和颅脑超声。


重症超声对于ECMO的实施及管理是重要的辅助手段,有助于ECMO的可视化及精细化管理。加强对重症超声的培训,以患者为核心,适当引入AI辅助,做到深入理解病理生理,才能做好对ECMO的优化支持。
作者介绍
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信