Omicron所致重症肺炎合并曲霉感染
作者:崔晓阳
单位:国家呼吸医学中心 中日友好医院呼吸与危重症医学科
患者,男性,73岁,主诉:发热10天,呼吸困难5天。入院时间:2022年12月25日。10天前患者因接触新冠感染家属后出现发热,伴咳嗽,无痰,体温最高38.4℃,自服布洛芬后体温可下降,但仍反复,体温波动于37.8~38.3℃。5天前于静息状态下感呼吸困难,咳嗽、咳黄痰,未用药,症状持续不缓解。3天前至当地医院就诊,完善胸部CT示“肺部感染”。2天前,测指脉氧饱和度70%左右,收入望京医院ICU病房,住院期间予“莫西沙星、糖皮质激素”治疗后症状无缓解,经120转入我院继续治疗。外院胸部CT可见右肺上叶有一较大空腔,右肺上叶胸膜下有一不规则结节,双肺弥漫磨玻璃影,下肺和胸膜下为著。既往史、个人史及家族史
2型糖尿病10年余,未控制饮食及监测血糖。8年前患肺结核,自述经治疗恢复。已接种三针新冠疫苗。吸烟30余年,日吸约20支,少量饮酒,无冶游史。体温37.5℃,脉搏107次/min,呼吸32次/min,血压150/80 mmHg。双肺呼吸音清晰,未闻及干/湿啰音,无胸膜摩擦音。心率107次/min,律齐,各瓣膜听诊区未闻及杂音,无心包摩擦音。腹部膨隆,无压痛、反跳痛,肝脾未触及,Murphy氏征阴性,无移动性浊音,肾区无叩击痛。肠鸣音正常,4次/min。四肢肌力、肌张力未见异常,双侧膝、跟腱反射正常,双侧Babinski征阴性。
新型冠状病毒肺炎(危重型),Ⅰ型呼吸衰竭;
急性呼吸窘迫综合征(重度);
2型糖尿病;
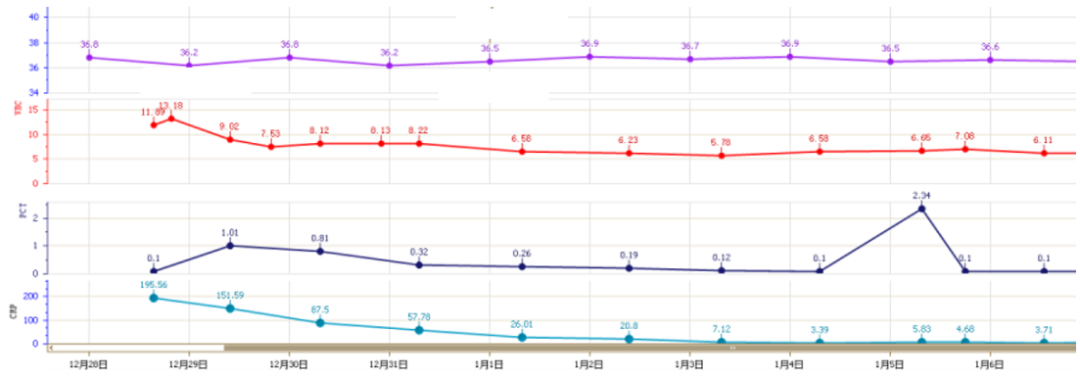
感染指标:WBC 11.21×109/L(↑),NEU 10.73×109/L(↑),LYM 0.29×109/L(↓),PCT 0.14 ng/ml。
病原学:新冠病毒核酸阳性(CT值37.2);血G、GM试验均阴性;曲霉Ig G 61.68;T-SPOT阴性;患者吸氧条件高,未能在普通病房完善气管镜检查。
免疫状态:淋巴细胞总数0.23×109/L。
炎症指标:CRP>200 mg/L,IL-6 51.05 pg/ml,Fet 626 ng/ml,LDH 556 IU/L。
血气分析(经鼻高流量FiO2 1.0):pH 7.40,PaCO2 43.4 mmHg,PaO2 74.0 mmHg,cLac 1.1 mmol/L,PFR 74 mmHg。
循环:Myo、CK-MB、cTnT均在正常范围内,NT-proBNP 325(<125)pg/ml;心脏超声显示心脏结构及功能无异常。
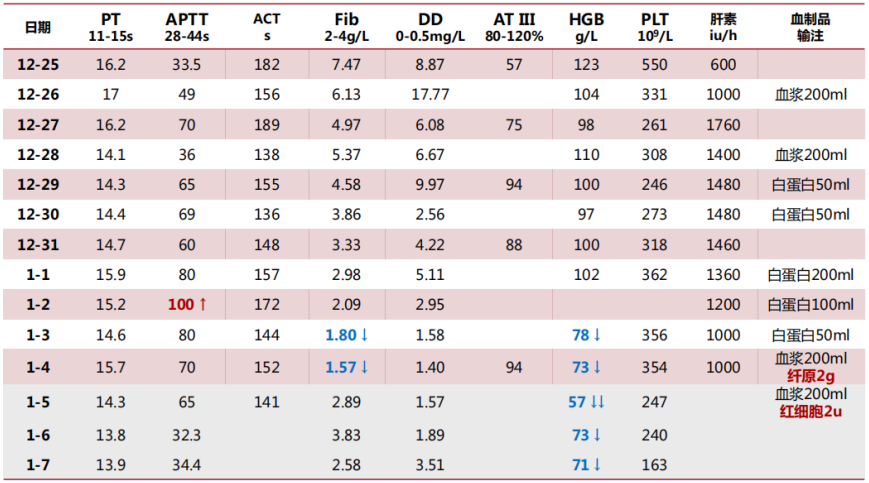
出凝血:PT 15.4 s(↑),APTT 38.3 s,PTA 71%(↓),Fib 5.17 g/L(↑),D-二聚体>20 mg/L(↑),FDP>160 μg/ml(↑)。下肢静脉超声示双侧小腿肌间静脉血栓。
肝功能:ALT 35 mmol/L,AST 26 mmol/L,TBIL 19.27 mmol/L,DBIL 4.99 mmol/L。
肾功能:Cr 64.3 mmol/L,BUN 5.67 mmol/L。老年男性,急性起病;
2型糖尿病、肺结核病史;已接种新冠疫苗;
发热、咳嗽、呼吸困难,家庭氧疗无法缓解症状,SpO2 70%;
查体:心率快、血压高、呼吸频数;
血气分析提示Ⅰ型呼吸衰竭;
WBC偏高、LYM降低;CRP、Fet、IL-6明显升高;
胸部CT可见右肺上叶肺大泡、不规则结节,双肺弥漫磨玻璃影。初始治疗方案
头孢他啶2 g q8h(12-25至12-28)抗感染;
联磺甲氧苄啶1片qd(12-25至12-28)预防性抗PCP;
那曲肝素4000 U qn(12-25至12-28)预防性抗凝;
甲强龙40 mg qd×2 d(12-25,12-26),80 mg×2 d(12-27,12-28)抗炎;
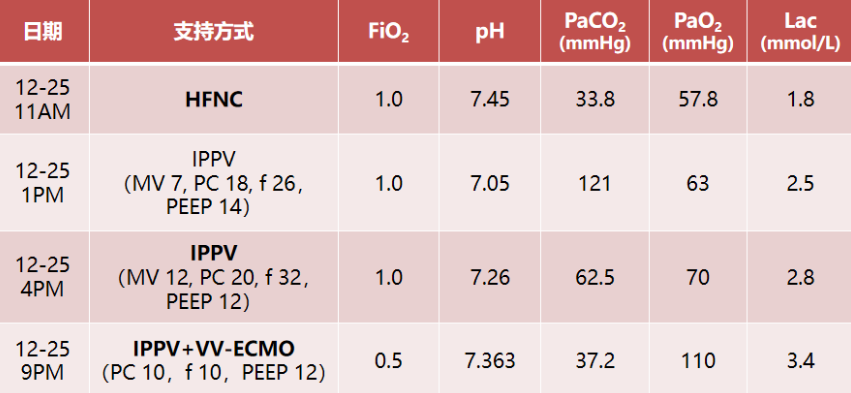
巴瑞替尼4 mg qd×2 d(12-26,12-28)抗炎。患者于普通病房时氧合进一步恶化,在HFNC FiO2 1.0条件下,氧饱和度波动于80%~85%,患者于2023年12月28日转入MICU。患者状态:神清,呼吸窘迫,RR 33次/min,PFR 86.2 mmHg,立即予以气管插管及呼吸机辅助呼吸。呼吸机参数:PC模式,PC 18 cmH2O,PEEP 10 cmH2O,FiO2 0.9。Crs 30 L/cmH2O,R 12.3 cmH2O·S/L,Vt 300 ml,MVe 10.7 L。血气分析(FiO2 0.9):pH 7.03,PaCO2 128 mmHg,PaO2 128 mmHg,BE -4.2 mmol/L, HCO3- 24 mmol/L,cLac 0.8 mmol/L,PFR 146 mmHg。
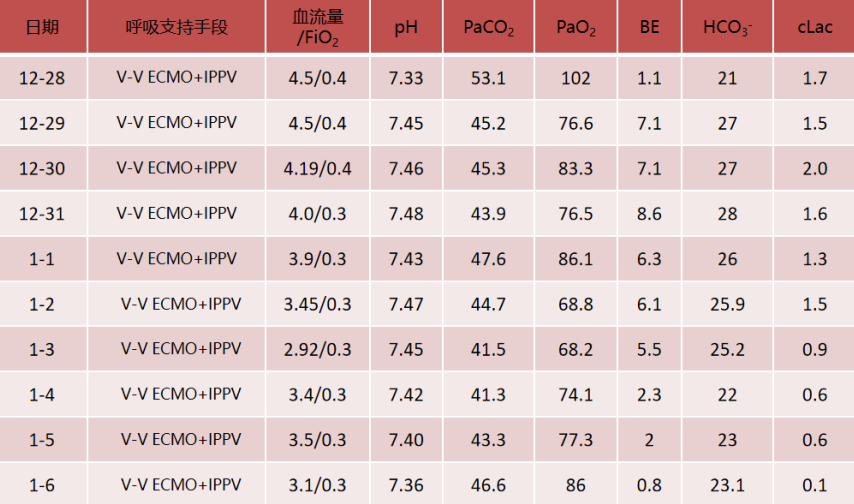
考虑患者此次主要为感染性疾病,有治愈的可能;患者影像学可见肺大泡,气压伤风险高,且存在严重的失代偿呼吸性酸中毒,遂升级呼吸支持方式。予以建立V-V ECMO:3495 r/min,血流量4.19 L/min,气流量4.5 L/min;IPPV PC模式,PC 12 cmH2O,PEEP 8 cmH2O,FiO2 0.35。
复查血气分析:pH 7.38,PaCO2 46.8 mmHg,PaO2 119 mmHg,BE 2.3 mmol/L,HCO3- 24.7 mmol/L,cLac 1.9 mmol/L。呼吸性酸中毒得以纠正。
完善气管镜检查,镜下见少许白痰,余无特殊,予以送检病原学。予以头孢哌酮舒巴坦3 g q8h抗感染。新冠核酸CT值>30,未予抗病毒治疗。
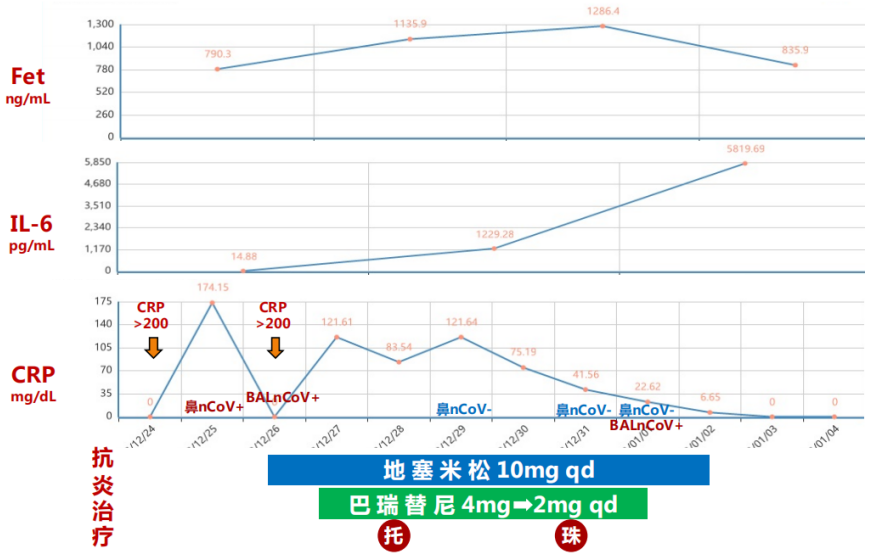
评估患者当前情况:①免疫状态:基础有糖尿病,血糖未严格监测;淋巴细胞总数224 cells/μl,CD4+T细胞158 cells/μl,患者基础免疫较差。②合并感染情况:病原学结果尚未回报,气管镜下可见气道黏膜较好,感染指标WBC偏高,初始状况尚可,密切监测病原。③炎症反应程度:CRP 151.59 mg/L,IL-6 186.06 pg/ml,Fet 809.5 ng/ml。④患者氧合差,病情进展速度。
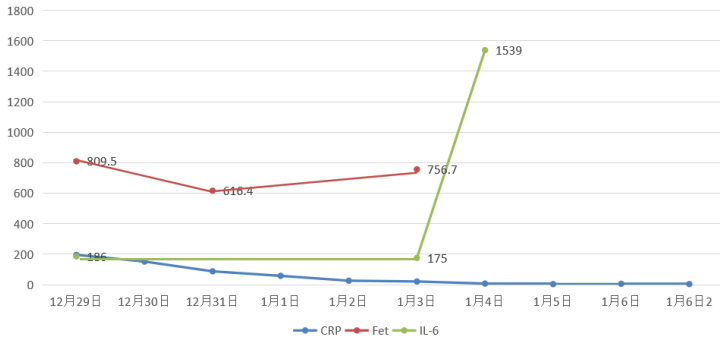
12月28日,予甲强龙40 mg qd联合托珠单抗8 mg/kg(480 mg)抗炎。治疗后,患者CRP水平明显下降;IL-6水平显著升高,符合托珠单抗的作用机制;Fet下降有轻度下降,但后续再次升高。
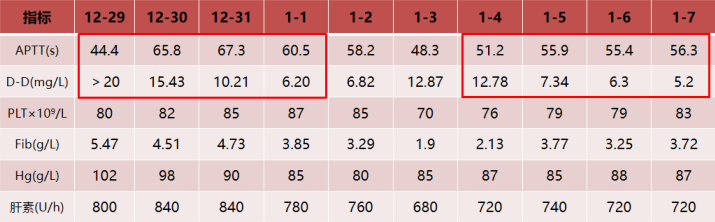
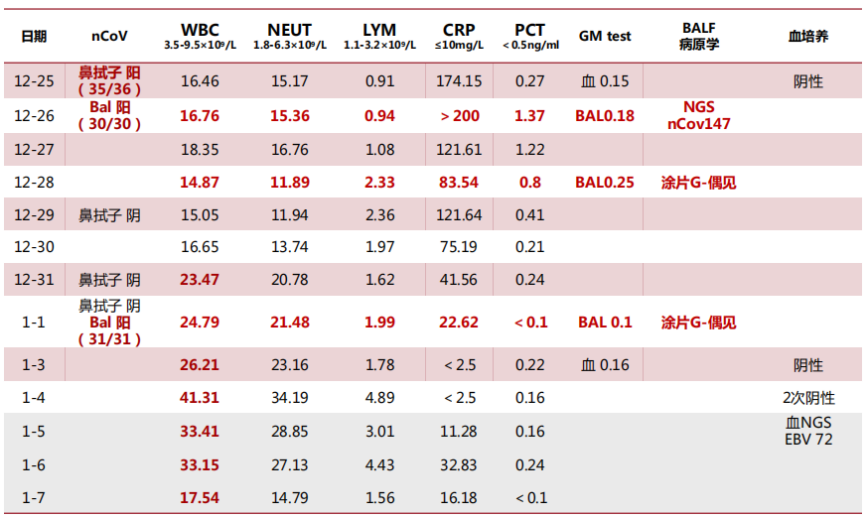
建立ECMO后,初始制定的APTT目标为60~65 s,抗凝达标后,患者D-二聚体明显下降。达到抗凝目标后,患者血红蛋白进行性下降,考虑可能存在出血情况,因此逐渐下调APTT目标值,在APTT为48 s左右时,血小板和纤维蛋白原的消耗很明显,D-二聚体升高,提示此时抗凝不足,逐渐上调APTT目标,当APTT为55 s左右时,D-二聚体能够维持在相对低水平,且血小板、纤维蛋白原、血红蛋白能够达到相对平衡状态。细菌/真菌涂片及培养未见细菌/真菌;
抗酸涂片、Xpert均阴性,弱抗酸染色阴性;
GM试验9.7;CMV核酸阴性,PCP核酸阴性;
NGS检测:土曲霉(序列数2781),烟曲霉(序列数192),新型冠状病毒(序列数1083)。停用激素,加用伏立康唑400 mg q12h→200 mg q12h抗曲霉治疗,异烟肼0.3 g qd预防性抗结核,联磺甲氧苄啶1片qd预防PCP。患者后期联合Paxlovid抗病毒,故同时监测伏立康唑的血药浓度,维持在达标范围;予以间断气管镜+俯卧位痰液引流。患者感染情况整体可控,WBC基本在正常范围,体温不高;1月4日,PCT出现一过性升高,患者前期抗炎强度较大,且有糖尿病基础,遂加用替加环素抗感染,之后患者感染指标恢复正常。
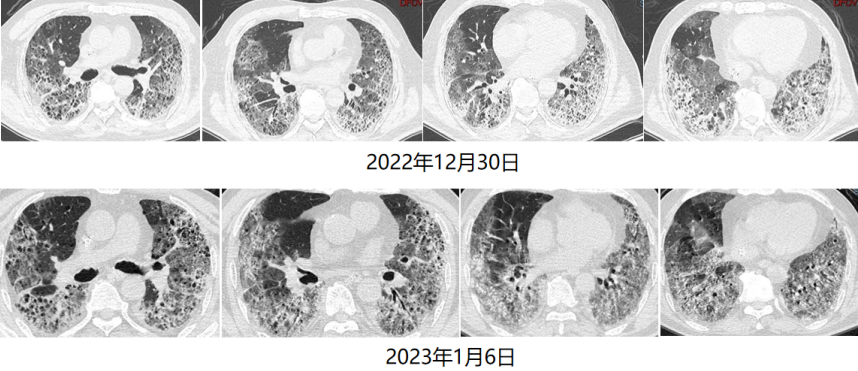
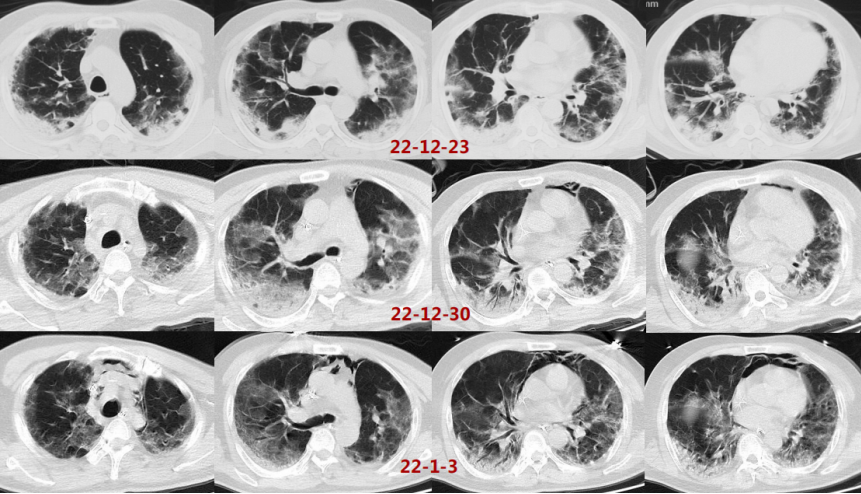
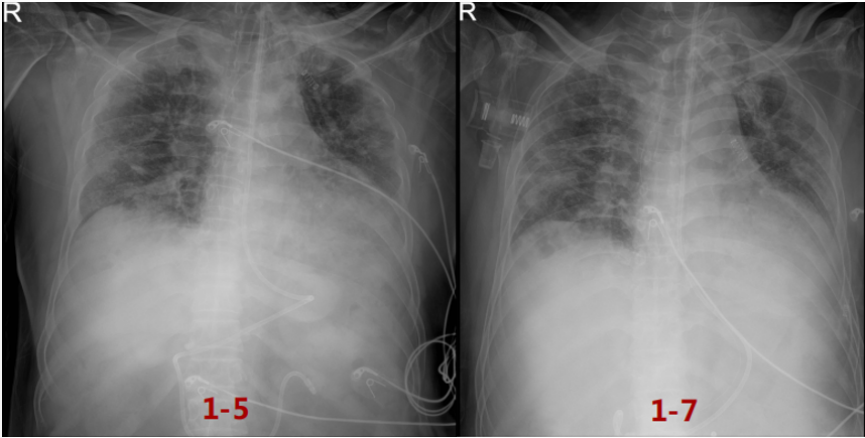
循环方面:患者心功能可,容量状态略微偏低,故未予过多限液。呼吸支持及氧合变化:12月28日建立VV-ECMO后患者的通气和氧合均得到明显改善,随着支持条件的逐渐下降,PaO2均可。患者于2023年1月6日行V-V ECMO心肺试验(cardiac-pulmonary test,CPT),在2 h时,患者血气分析、氧合指数能够维持,且无呼吸窘迫情况出现。1月6日复查胸部CT:双肺渗出吸收不理想,双下肺病变较前无明显变化。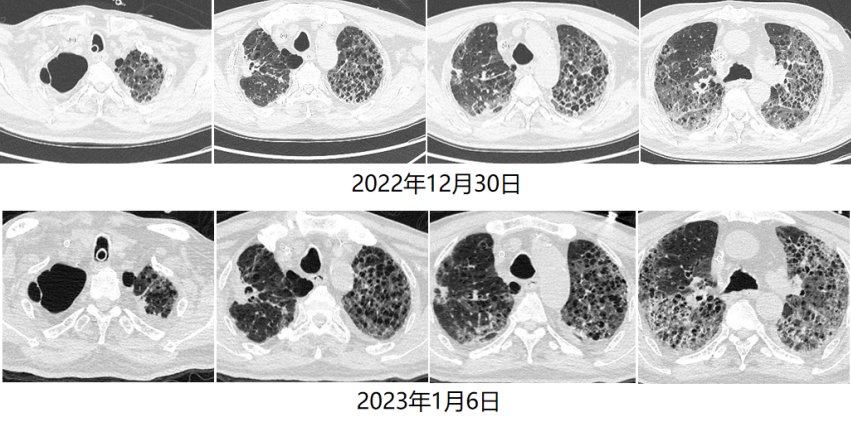
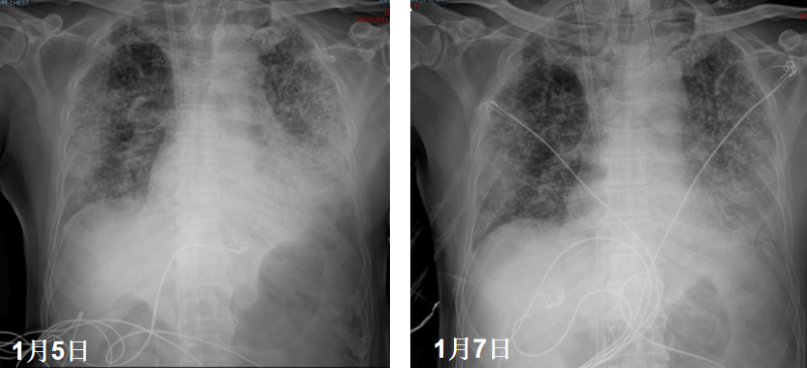
患者前期明确有曲霉感染,遂停用了抗炎治疗。经过前期治疗,患者氧合有所改善,但影像学表现欠佳,此时能否脱离ECMO单用有创机械通气支持?下一步抗炎,还是加强抗感染?炎症方面:患者前期经过抗炎治疗,CRP水平降至4.68 mg/L,IL-6水平进行性升高(1539→1898.25 pg/ml,与IL-6受体拮抗剂作用机制有关),Fet明显升高(756.7→1389.1 ng/ml)。免疫方面:患者当前LYM 0.29×109/L,一方面可能提示其免疫功能欠佳,另一方面,炎症反应非常活跃时会诱导淋巴细胞加速凋亡,淋巴细胞进入组织可导致外周血淋巴细胞计数下降。感染方面:经过抗感染治疗,患者体温正常,镜下痰量不多,WBC、PCT正常;多次监测病原学,最近一次BALF GM转阴。1月6日加用托珠单抗480 mg抗炎治疗。1月7日复查胸片可见双肺渗出有所吸收,将ECMO血流量降至2.8 L/min。呼吸机FiO2 0.3,氧合似乎能够维持在稳定状态。截至本专题讲课时,患者仍在进一步治疗。
(1)抗炎时机:对于COVID-19重型/危重型患者,早期虽然有合并感染的可能,但多项研究也提示抗炎治疗应尽早(入院48~96 h)启动,这是由于早期炎症反应相对剧烈,且无合并院感等一系列复杂的问题。(2)抗炎之前一定要充分评估患者的免疫状态和共感染情况;综合我院收治的几例COVID-19合并曲霉感染患者的情况,气管镜下并无典型的曲霉感染特征(如气道侵袭、分泌物等),仅凭气管镜下表现评估患者的共感染情况,并不绝对准确。因此,患者入院后及时完善气管镜和病原学检查极为重要。(3)抗炎与感染之间的平衡:对于COVID-19重型/危重型患者,通常抗炎强度较大,需要充分评估患者免疫状态、合并感染情况及疾病阶段。(4)抗炎药物选择:在WHO第十二版指南中提出了激素+巴瑞替尼+托珠单抗对危重型COVID-19患者的抗炎治疗,但仍存在争议。由于三联抗炎对机体的免疫抑制非常强烈,后续合并感染及合并血栓栓塞的风险可能会增加。而且,巴瑞替尼在机械通气患者中获益的证据有限。目前我中心更倾向于激素+托珠单抗抗炎治疗。(5)抗炎持续时间:临床中有部分患者经过前期强有力的抗炎治疗后,氧合和影像学都能够改善,但后续病情进入瓶颈期,改善并不理想,是否需要序贯治疗?如何选择药物?
ECMO救治COVID-19患者一例
作者:田野
单位:国家呼吸医学中心 中日友好医院呼吸与危重症医学科一般情况
患者,男性,58岁,身高168 cm,体重70 kg,2022年12月24日入院,2022年12月25日入ICU。主诉:发热伴咳嗽、咳痰、呼吸困难15天,加重8天。现病史
第一阶段(当地医院呼吸科)
入院15天前(12月9日)出现发热,T 39℃,伴畏寒、咳嗽、咳痰、呼吸困难,自服布洛芬、阿莫西林等。入院8天前(12月16日)呼吸困难加重,伴高热(体温39℃),指氧饱和度80%(未吸氧),新冠核酸(+),血常规(12月21日):WBC 9.04×109/L,LYM 1.01×109/L,CRP 156 mg/L,PCT<0.072 ng/ml;胸部CT考虑新冠肺炎。血气分析(12月21日,吸氧条件不详):pH 7.48,PaCO2 29 mmHg,PaO2 56 mmHg,HCO3- 21.6 mmol/L,Lac 2.3 mmol/L。当地给予吸氧、激素、抗生素治疗(具体不详)。第二阶段(转入我院急诊)
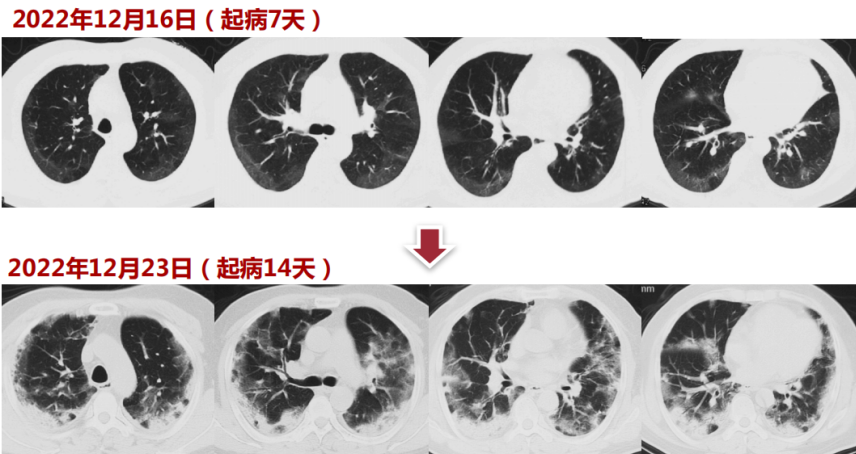
1天前因胸部CT(12月23日)加重转入我院急诊。新冠核酸(12月24日,阳性)。血常规(12月24日):WBC 10.77×109/L,NEU 10.28×109/L, LYM 0.37×109/L,CRP>200 mg/L,PCT 0.18 ng/ml。血气分析(12月24日,面罩15 L/min):pH 7.47,PaCO2 32 mmHg,PaO2 71 mmHg,HCO3- 25 mmol/L,Lac 1.0 mmol/L。凝血(12月24日):D-D 6.88 mg/L,FDP 23.14 μg/ml。HFNC+化痰+莫西沙星治疗1天后转入呼吸科。起病后精神、食欲、睡眠欠佳,二便正常。胸部CT:起病7天,患者双肺胸膜下可见浅淡磨玻璃影;起病14天,胸膜下可见实变影伴周围磨玻璃影,病变范围较前扩大。2型糖尿病1年,不规律服用卡格列净1片(早餐前),二甲双胍缓释片0.5 g(午餐及晚餐前),空腹血糖约7 mmol/L。否认高血压、冠心病、脑血管病病史;否认肝炎、结核等病史;否认手术、外伤、输血史;否认食物、药物过敏史;无吸烟史,无酗酒;适龄婚育,家族史无特殊。T 37.2℃,HR 93 bpm,RR 23 bpm,BP 116/55 mmHg,SpO2 93%(HFNC FiO2 1.0,45 L/min)。神清,精神差,查体欠配合。双肺呼吸音清,双下肺可闻及湿啰音;心界无明显扩大,心律齐,各心脏瓣膜区未闻及杂音;腹软,无压痛、反跳痛及肌紧张,肠鸣音4次/min;双下肢无凹陷性水肿。新型冠状病毒肺炎(危重型),Ⅰ型呼吸衰竭,2型糖尿病。初始治疗
呼吸支持:HFNC FiO2 1.0,50~60 L/min,静息状态下SpO2维持在90%~98%;RR 20~35 bpm。抗炎:于原有激素治疗基础上依据炎症指标加用托珠单抗或巴瑞替尼抗炎。其他:哌拉西林,雷贝拉唑,沐舒坦,磺胺,控制血糖。完善炎症指标筛查及脏器功能的评估。
心脏功能评估
超声心动图提示右心扩大,三尖瓣反流(轻度),肺动脉压轻度增高(估测肺动脉收缩压约48 mmHg);右室功能稍减低。
呼吸功能评估
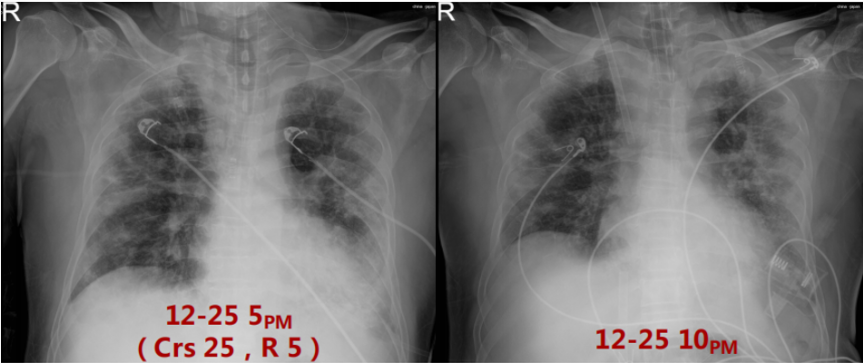
入科时,患者呼吸支持方式为HFNC,患者PFR<100 mmHg,故于当天下午行气管插管。呼吸机IPPV PC 18 cmH2O,PEEP 14 cmH2O,f 26次/min,监测分钟通气量(MV)7 L/min。粗测床旁呼吸力学指标,顺应性(Crs)25 ml/cmH2O,气道阻力(R)为5 cmH2O/(L·s)。插管后约半小时,患者出现严重的呼吸性酸中毒,调整呼吸机参数:PC 20 cmH2O,PEEP 12 cmH2O,f 32次/min,监测MV 12 L/min。复查血气分析PaCO2明显下降,但氧合指数持续小于80 mmHg,遂于12月25日晚行VV-ECMO。ECMO第1天炎症、免疫、感染指标(12月26日)Fet 790 ng/ml,CRP>200 mg/dl,IL-6 14.88 pg/ml;
细胞免疫:CD4+T细胞671 cells/μl;
体液免疫:免疫球蛋白、补体大致正常;
感染指标:T 36.5℃,WBC 16.76×109/L,PCT 1.37 ng/ml。抗炎治疗:地塞米松+巴瑞替尼+托珠单抗(2剂);
呼吸支持:IPPV+VV-ECMO,保护性通气策略,气管切开;
感染监测:监测共感染、VAP、ECMO相关感染情况;
凝血平衡:通过监测PT/APTT/ACT/DD/ATⅢ评估抗凝是否充分,通过Fib、PLT及Hb判断患者出血风险;
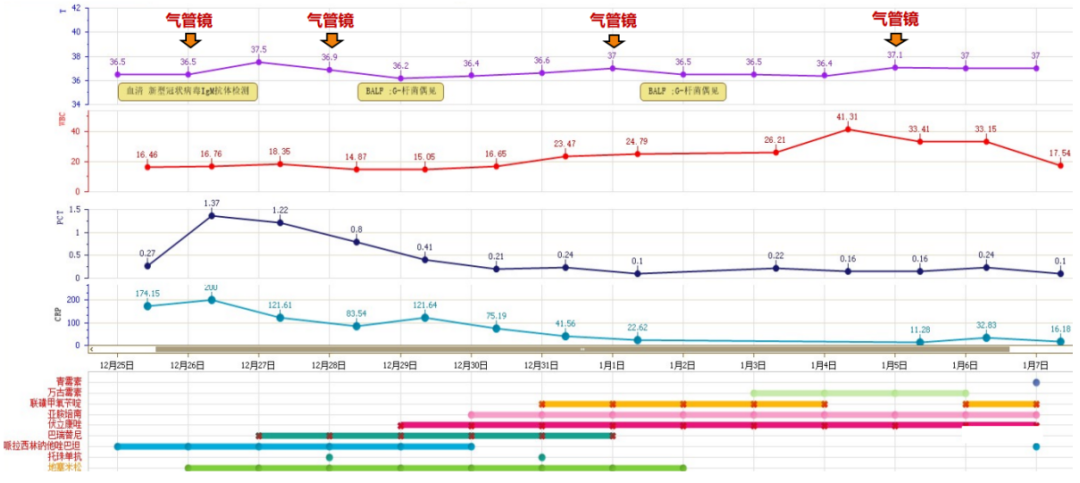
炎症指标:患者入院后鼻咽拭子新冠核酸阳性,入院后5天鼻咽拭子新冠核酸转阴;入院后BAL新冠核酸持续阳性,CT值约30左右。在抗炎治疗前,受病毒感染等因素影响,患者Fet、IL-6、CRP均较高,加用地塞米松、巴瑞替尼、托珠单抗后,患者CRP呈下降趋势;Fet前期变化较慢,在12月底呈下降趋势。氧合:抗炎治疗主要集中于ECMO支持后的第1周。ECMO支持期间,呼吸机及ECMO支持参数变化不大,在同等呼吸支持条件下,从1月2日开始,患者PaO2显著改善。初始三联抗炎治疗对改善患者氧合有一定效果。

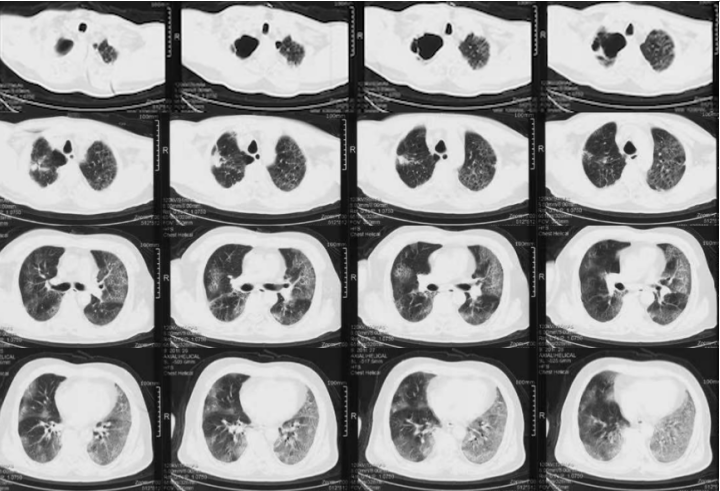
注:VV-ECMO参数:2700~3045 r/min,BF 3.4~3.9 L/min,GF 3 L/min,FiO2 1.0影像:下图分别是患者起病14、21及25天的胸部CT对比,在抗炎之后,患者肺部实变部分有明显吸收,且范围缩小。患者影像学变化过程:单纯磨玻璃影→实变伴磨玻璃影→实变、磨玻璃影伴牵拉性支气管扩张。综合上述,抗炎治疗后患者炎症指标下降、氧合改善、影像学吸收,综合判断抗炎治疗有效。患者在插管后出现了严重的酸中毒,在增加分钟通气量后,仍难以改善高碳酸血症和低氧,故选择ECMO支持。插管后3天,为了加强气道管理予气管切开。在ECMO支持7天后,复查胸部CT发现少量纵隔气肿,故于当天下调PEEP至6 cmH2O。追溯患者发生气压伤的原因,可能与过高的呼吸驱动有关,上调瑞芬太尼和丙泊酚的泵入速度,加深镇痛镇静。2023年1月1日患者PaO2较前稍有下降,查体双肺湿啰音,无皮下气肿及气胸表现,所以再次上调PEEP至8 cmH2O。经过上述处理,患者呼吸频率仍在25次/min左右,潮气量约为500 ml。1月3日患者出现寒战,ECMO抖管,再次复查胸部CT发现纵隔气肿较前加重,下调PEEP至4 cmH2O。在瑞芬太尼镇痛基础上应用丙泊酚+咪达唑仑双联镇静,患者呼吸频率下降,维持在20次/min左右,潮气量降至400 ml。
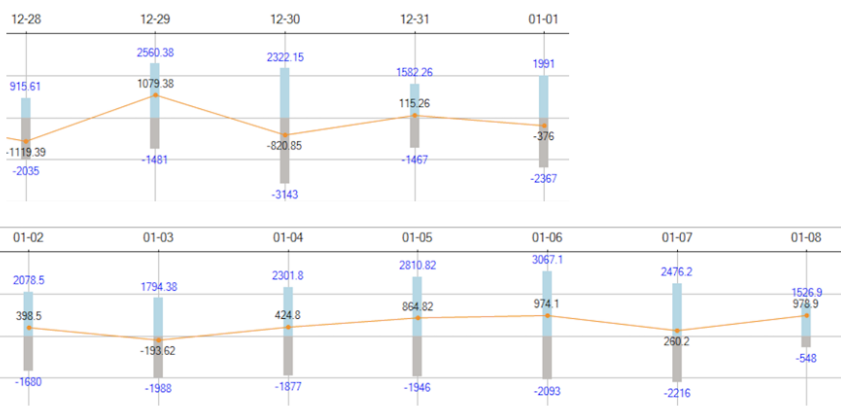
注:VV-ECMO参数:2700~3045 r/min,BF 3.4~3.9 L/min,GF 3 L/min,FiO2 1.0;ECMO初期实际RR 26~30 bpm,Vc 400+ ml(1)早期气切(ECMO插管后第3天):主要考虑:①该患者需要有创机械通气的时间和肺修复时间可能会较长;②气切后评估镇静、镇痛药物的停用,早期康复的介入。(2)气压伤后处理:①下调PEEP;②增加ECMO流量;③加强镇痛、镇静;④监测纵隔气肿范围。患者起病1周左右(院外)感染指标无明显变化,入我院后出现WBC和NEU的明显升高,建立ECMO后,患者PCT升高。ECMO第1天行气管镜检查,镜下可见气道分泌物不多,气道黏膜无明显充血水肿表现。12月26日BALF NGS结果显示除新冠病毒,并无真菌及其他细菌感染证据。12月30日(ECMO支持1周左右),WBC相对稳定,12月28日BALF培养结果无VAP相关证据。12月31日开始,患者WBC持续增高。2023年1月1日气管镜下可见少许血性分泌物,BALF培养阴性,期间多次采集外周血及导管血进行培养,结果均为阴性。下图为患者体温、WBC、PCT、CRP变化的趋势及抗炎、抗感染治疗汇总。初始无共感染,予哌拉西林他唑巴坦预防,经过气管镜评估没有共感染证据,继续使用哌拉西林他唑巴坦。抗炎治疗4天后曲霉感染风险高、细胞免疫功能下降,故于早期联合伏立康唑和磺胺预防曲霉和PCP。ECMO后第5天,患者WBC明显升高,BAL两次细菌涂片见少量G-杆菌,将哌拉西林他唑巴坦升级为亚胺培南,同时监测患者下呼吸道病原学,未培养出VAP常见病原体。患者循环相对稳定,未应用血管活性药物。ECMO支持第10天,患者出现寒战、白细胞骤然升高,出现休克,需血管活性药物维持血压,加用万古霉素,经验性覆盖阳性菌,同时评估ECMO撤离。撤离ECMO之后,患者感染指标明显下降,尤其是WBC,遂将药物降级为哌拉西林他唑巴坦。感染方面的另一个需要关注的问题是ECMO相关感染的监测,我们通常会结合ECMO的运转时间、患者体温、WBC、PCT以及血培养结果、穿刺点周围皮肤情况等综合判断患者ECMO相关感染风险。ECMO第10天,患者出现寒战、休克、血象升高,加用万古霉素预防血流感染,同时进行液体复苏,共补液13500 ml。但患者无发热,PCT阴性,穿刺处皮肤正常,肺部和腹部情况相对稳定;多次血培养阴性,血NGS回报EBV(序列数72),因此对于ECMO血流感染的诊断仍缺乏病原学证据。在患者氧合允许的情况下,1月4日夹闭ECMO气源。1月5日撤离VV-ECMO。1月2日,患者ATPP显著升高,Fib大量消耗,Hb急速下降,床旁查体,皮下无瘀斑,胃管回抽无出血,大便颜色正常,超声探查腹腔及腹膜后,无液性暗区,失血性休克证据不足。1月3日患者出凝血功能异常,肝素减量,评估ECMO撤机。撤离ECMO,补充血制品,补液,患者Hb稳定在8 g/L左右,血管活性药物逐渐减停。心功能:2022年12月29日心脏超声示右心扩大,监测心功能稳定,心电图大致正常,心肌标志物正常;2023年1月5日心脏超声结果大致正常。
肝肾功能:异甘草酸镁+还原型谷胱甘肽保肝,早期代酸、尿少→CRRT。
胃肠道:抑酸,早期空肠管后开启肠内营养,监测血糖、排便情况。
营养:制定总热卡、总蛋白摄入量;选择糖尿病配方肠内营养。患者ECMO期间未发生VAP,ECMO后期出现的可疑血流感染,通过补液、撤离ECMO等措施得到了控制,在ECMO支持2周后成功撤离。
IPPV支持下的呼吸机维护及管理:加强镇静、镇痛;下调呼吸机参数(PEEP 6→4 cmH2O),并通过床旁胸片评估患者气压伤情况。
抗菌治疗:血流感染和VAP证据不足,降级抗阴性杆菌药物;预防应用磺胺、伏立康唑预防真菌和PCP。
呼吸支持:2023年1月5日撤除ECMO后,IPPV参数下调,镇静、镇痛。
抗凝治疗:患者Hb相对稳定之后,予低分子肝素4000 IU qn预防性抗凝。
对于该患者,在气压伤的管理和出凝血评估方面仍有待加强。疑问
(1)该患者的抗炎治疗主要集中于ECMO后1周内,两次BALF核酸均为阴性(2022年12月16日,2023年1月1日)。三联抗炎后小剂量序贯抗炎(激素or巴瑞替尼)的有效性如何?(2)ECMO第10天患者出现寒战、休克、WBC升高,但患者无发热,PCT未升高,血培养阴性。如何考虑该病情变化?感染性休克?ECMO相关全身炎症反应综合征(SIRS)?(3)该患者ECMO支持下/撤离后的气压伤,处理措施是否得当?
专家讨论
本期两个病例都是需要ECMO救治的重症肺炎患者。ECMO是一项生命支持技术,为患者提供救治的时机,所以在实施时仍需要有一定的考量。对于COVID-19患者,当传统治疗方法未能达到预期效果时,ECMO是最后一种能够维持患者生命的技术。所以在实施这项技术时,适应证的把握要相对严格,需要考虑多种因素,而且ECMO的实施相对风险较大,管理比较复杂。ECMO管理过程中,更多是在原发病的救治,只有原发病得到救治,才能撤离ECMO。本期的两个病例相对高危,基础都有糖尿病,年龄偏大,疾病已进展为重症肺炎。尽管缺乏循证依据,个人认为对于此类患者,抗病毒药物仍可使用,因为此类患者体内仍然存在病毒复制,可能会出现再感染或再次形成炎症。从疾病演变过程分析,在疾病早期,阻断炎症风暴,患者可能会有更多获益,而在疾病后期,感染是主要问题,需予以更多的关注。另外,如果此类患者经过长时间的ECMO支持,肺部没有再恢复的可能,肺移植也是一种选择,但重症COVID-19患者肺移植后的长期预后并不理想。Paxlovid主要作用于新冠病毒3CL蛋白酶,虽然它具有相对较高的保守度,但仍有文献报道在M蛋白上的某个氨基酸突变后,可以导致奈玛特韦耐药,但奈玛特韦与利托那韦的关键位点不同,所以尽管新冠病毒发生很多突变,但Paxlovid仍然具有较好的抗病毒效果。新冠病毒的突变是否会产生耐药性,至少目前还没有类似的研究结论。在抗炎方面,个人会将托珠单抗用于相对早期的患者,患者有特征性的临床表现,我们也有患者IL-6>5000,但前提是确实找不到细菌感染的依据,此类患者使用托珠单抗的效果非常好。在激素应用方面,需要根据患者肺部病灶以及基础状态来选择药物剂量和疗程,在激素使用超过5天后,需要对患者进行再评估,以决定后续的疗程和剂量。不同的菌株,临床表现也存在一些差异,实施保护性通气策略可能会有所不同。ECMO的实施确实能够帮助我们赢得一些时间,减少机械通气对肺的再次损伤,有部分患者能够从中获益。对于没有结构性肺病或者病程较短的患者,在7天之内,我不建议做气管镜的常规检查,除非我们要了解患者的免疫状态,或者有基础性结构性肺病需要进行鉴别,或者科学研究的需要,而且此类患者在病程早期也不需要使用抗生素,除非有感染或炎症指标升高的证据。在5~7天后,我们需要严格评估患者是否需要进行气管镜检查。ECMO早期涉及抗凝的问题,而COVID-19本身也需要抗凝,如何在二者之间寻求平衡,这很关键。D-二聚体非常高的患者往往预后较差,也会被纳入ECMO治疗队列中,如何把握APTT和D-二聚体之间的平衡,这也是ECMO治疗成功的关键。在新冠病毒感染1~2周后甚至更长时间,会面临合并细菌/真菌感染问题,大大增加了治疗难度。COVID-19在绝大多数情况下有病毒性肺炎的共性,对于COVID-19的救治我们应该保持正常心态。在新冠肺炎的治疗中,会涉及诸如小分子药物怎么用、何时用、第一轮用完后第二轮能否再用等问题。在重症流感的治疗中,并没有研究确切证实奥司他韦在过了时间窗后再使用的疗效如何,所以推测可能Paxlovid也与此类似。有很多专家认为,可能在未来短时间内,Paxlovid在重症患者中的临床研究会有结果,但个人认为这仍有待商榷。对于目前热议的抗炎治疗,我们可能要慎重。我们要明确,使用激素、托珠单抗、巴瑞替尼等进行抗炎治疗主要针对的是什么。对于收入ICU的患者,病程最短可能已经7~10天,如本期第一例患者,后期合并真菌感染,上呼吸机后出现的炎症反应指标升高一定是COVID-19所致吗?本期两例患者插管上呼吸机后,二氧化碳分压都有增高,似乎在插管时患者已经存在明显的气道引流不畅,虽然潮气量足够,但死腔通气量明显增加,或者呼吸肌疲劳,所以才会出现二氧化碳潴留。如果是这种情况,这还是COVID-19的特征吗?对于这样的患者,我们考虑使用抗炎治疗,尤其是这种组合式抗炎治疗时,需要慎重。对于ICU中的重症COVID-19患者的抗炎治疗,我更倾向于保守。ECMO的建立很容易,但即使50年过后,ECMO的适应证仍然可能是令我们纠结的问题。对于刚插管上呼吸机的患者,如果氧合能够维持得住,建议先观察一段时间,因为刚插管时患者的通气极不稳定,可能需要数小时或1天的时间进行监测。我并不赞同有些专家提出的ECMO或机械通气的关口前移。在临床实践中,我们并没有发现重症COVID-19 ECMO患者在抗凝方面与既往流感患者不同。Paxlovid对ECMO患者的镇痛镇静、循环管理、其他脏器功能的影响及其与抗凝药物之间的相互作用,仍需要更多的实践和积累进行验证。第二个病例中有关患者自身造成的肺损伤,既可能与长时间的呼吸机设置有关,也可能与瞬时的因素及患者状态有关,不一定是策略的问题。作者介绍

崔晓阳
中日友好医院呼吸与危重症医学科主治医师,毕业于四川大学华西临床医学院,完成PCCM专科培训,从事呼吸危重症相关临床及科研工作,主要研究方向为ECMO相关呼吸支持手段,以第一作者在相关领域发表SCI论文多篇

田野
中日友好医院呼吸与危重症医学科,中国康复医学会呼吸康复专业委员会危重症康复学组秘书,中华医学会呼吸病学分会与美国胸科医师学会认证PCCM专科医师,美国南加州大学医学院访问学者,参与国家级科研项目1项及省部级课题3项,第一/通讯作者发表SCI多篇,参编或编译专著5部
*本文根据“Omicron变异株所致重症Covid-19临床救治实战系列”第六期视频整理,感谢崔晓阳医师和田野医师予以审核。
 后可发表评论
后可发表评论




 公众号
公众号
 客服微信
客服微信