登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:赵洪文




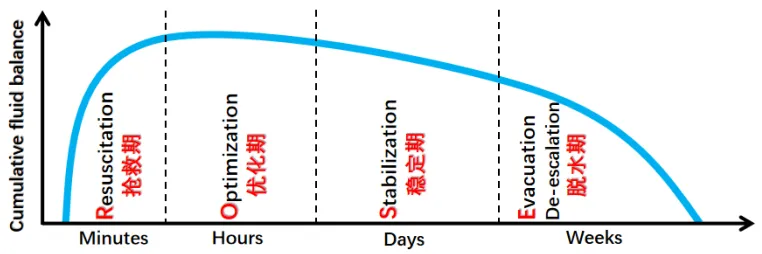
低血容量导致组织灌注减少,可出现诸多不良结局,例如:吻合口漏,意识模糊和脑卒中风险,内脏缺血,肾衰竭,多脏器衰竭。而液体过负荷可导致组织水肿,腹内高压,呼吸衰竭,愈合不良,肾衰竭,多器官衰竭。因此,血管充盈不足和液体过负荷都是有害的。“最佳补液量”是临床医生需要探讨的问题。在脓毒症和脓毒性休克的早期阶段,液体复苏至关重要。为避免液体超载的有害影响,初始复苏后进一步的静脉输液应在精确评估血管内容量(宏观循环)和器官灌注(微循环)的指导下进行,其目标是既改善组织灌注又不引起相关损害。

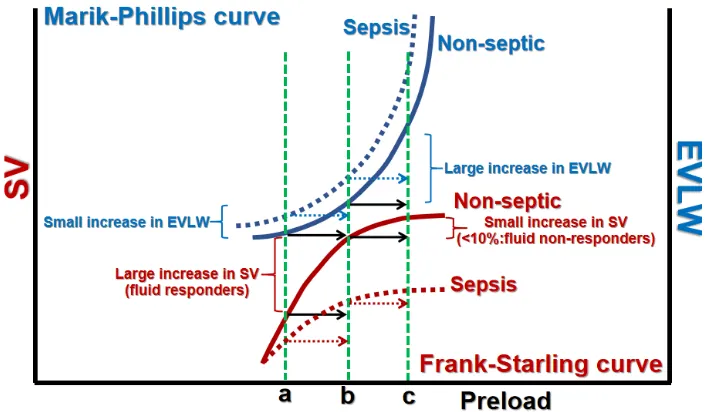
图1 补液量(增加前负荷)对SV和EVLW的影响
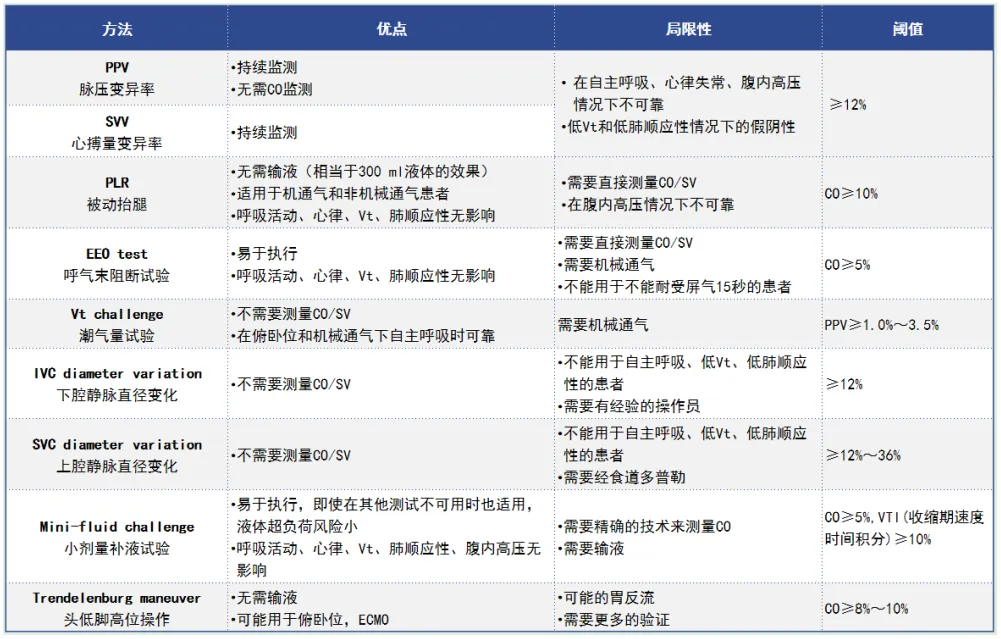
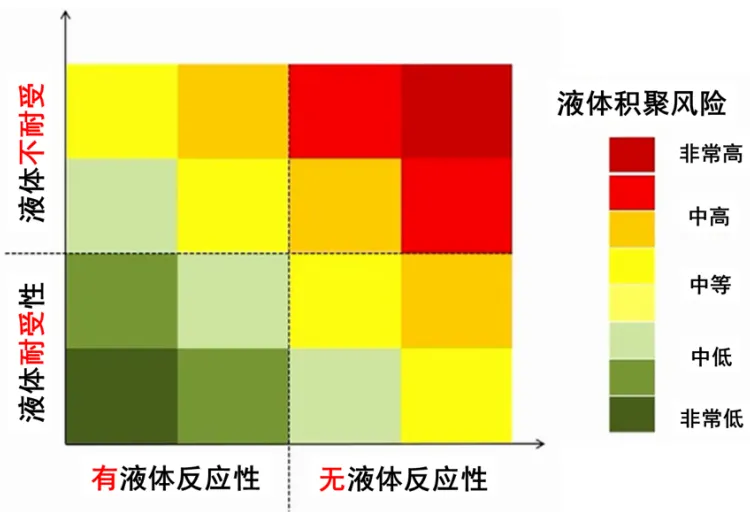
图2 液体反应性的评估试验
有学者将基于液体反应性的液体管理方法制作了流程图(图3)。首先要评估患者是否有液体复苏指征,如未出现组织灌注不足征象(血压降低、CRT延长、皮肤花斑评分高、乳酸升高、ScvO2下降、Pv-aCO2升高等),可先观察再评价;如果出现组织灌注不足表现,则需要评价液体反应性(10~15 min内予5~10 ml/kg或250~500 ml液体):①若心输出量增加,CVP、EVLW和静脉淤滞(VS)轻微改变,说明液体反应性较好,继续补液即可;②若心输出量无变化,CVP、EVLW和VS也没有明显变化,则不能确定是否有液体反应性,此种情况也可以继续补液;③若心输出量增加,CVP、EVLW和VS也明显增加,但无法确定获益和风险,应谨慎补液;④若心输出量不增加,但CVP、EVLW和VS明显增加,表明液体不耐受,此时应停止补液。如果评价液体无反应性,可选择其他干预方法,例如使用血管活性药物等。
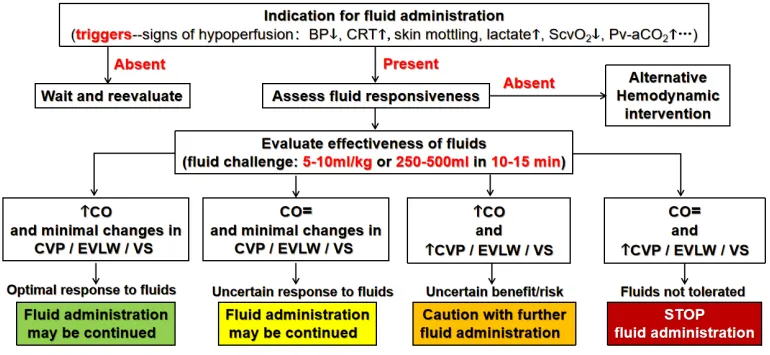
图3 基于液体反应性的液体管理流程图
(3)皮肤花斑评分:皮肤花斑严重程度与组织灌注、皮肤氧合和血红蛋白含量的局部损伤以及内皮功能障碍的生物学标志物相关。脓毒症复苏期间的皮肤花斑评分的变化趋势可以帮助指导液体复苏,因其与微循环有关,并可能具有预后价值。


参考文献
作者介绍
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信