登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:顾思超

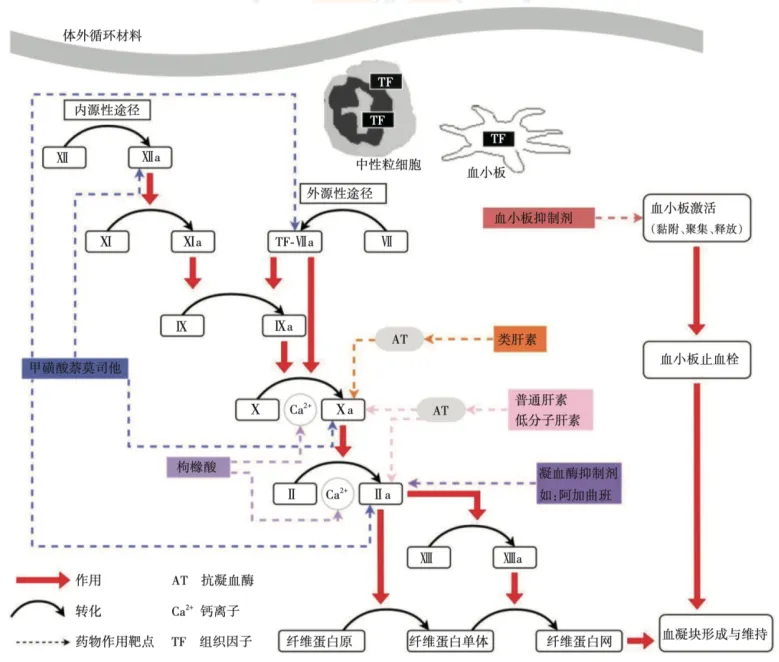
ECMO患者为什么要抗凝?其根本在于:①机械力对血液成分的破坏;②血液暴露于管路的非生物表面。凝血过程常分为内源性、外源性、共同凝血途径,临床医师也会采取针对性处理(图1)。
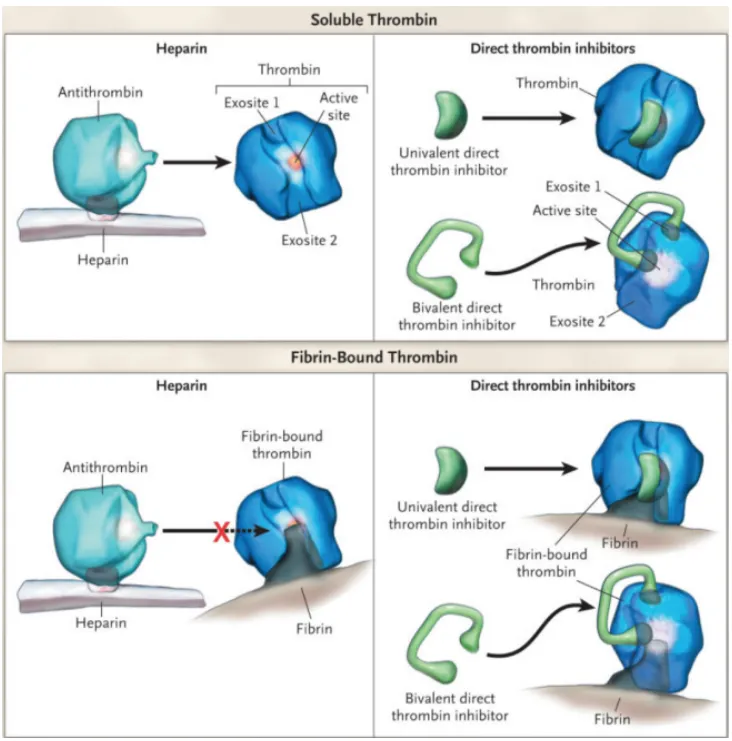
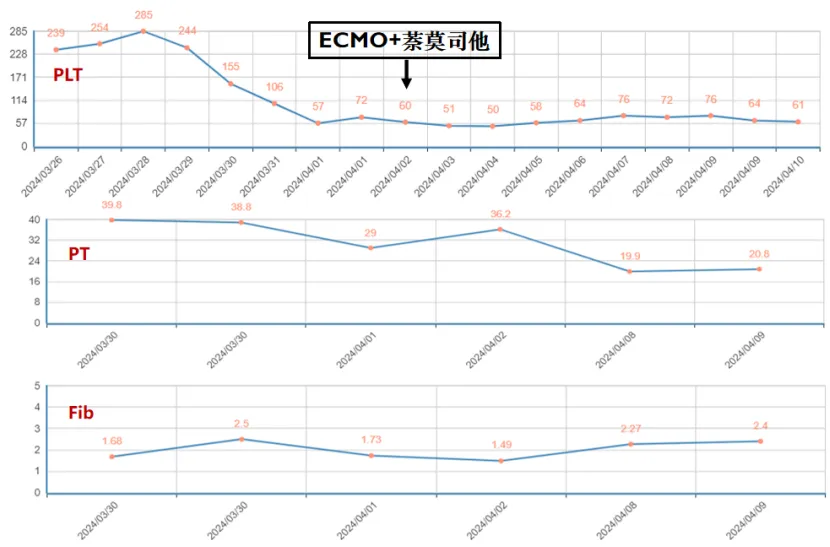
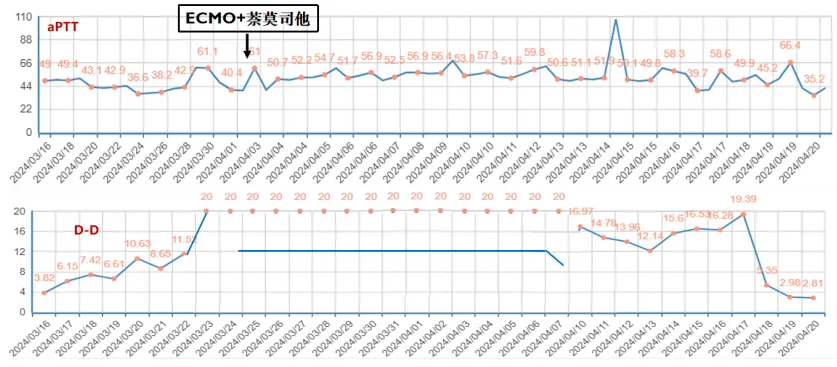
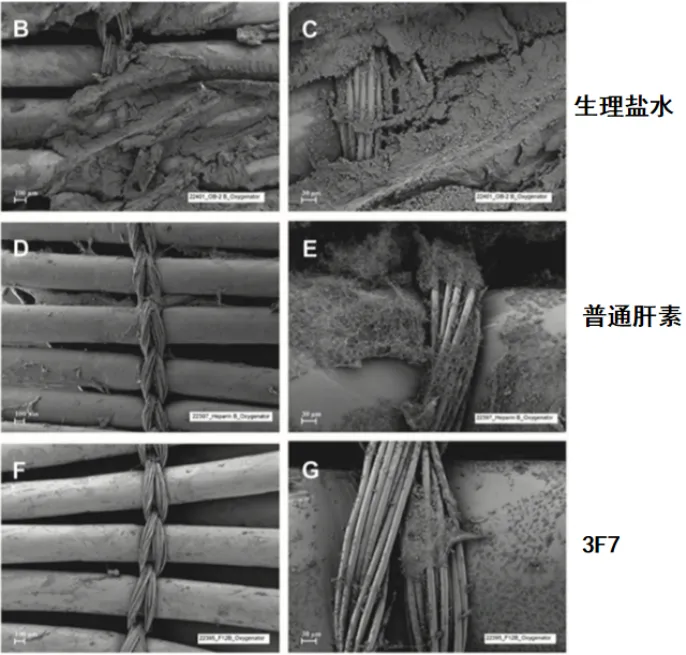
2023年发表的一项荟萃分析和系统评价比较了肝素、阿加曲班、比伐芦定、萘莫司他抗凝策略及预后,研究共入组23项研究2522例患者,主要结果为器械相关血栓、患者相关血栓和大出血事件,次要结果为ECMO存活率、ECMO时间和院内死亡率。结果显示:与肝素抗凝相比,比伐芦定主要结局指标最优,阿加曲班在患者血栓、出血方面最差,萘莫司他在器械相关血栓方面最差。在次要结局指标中,研究所用几种药物在ECMO时间和ECMO存活率之间无显著差异;萘莫司他可降低院内死亡率,但亚组分析未见优势。分析原因:首先,该研究为回顾性研究,患者抗凝药物选择存在主观性,例如VA-ECMO患者可能采用比伐芦定抗凝,其他患者可能选择阿加曲班或萘莫司他抗凝;其次,抗凝目标不尽相同,例如VA-ECMO患者的抗凝目标可能更高;最后,该研究未纳入插管、流量等因素的影响。所以目前这几种抗凝药物在临床选择方面没有太多差异。

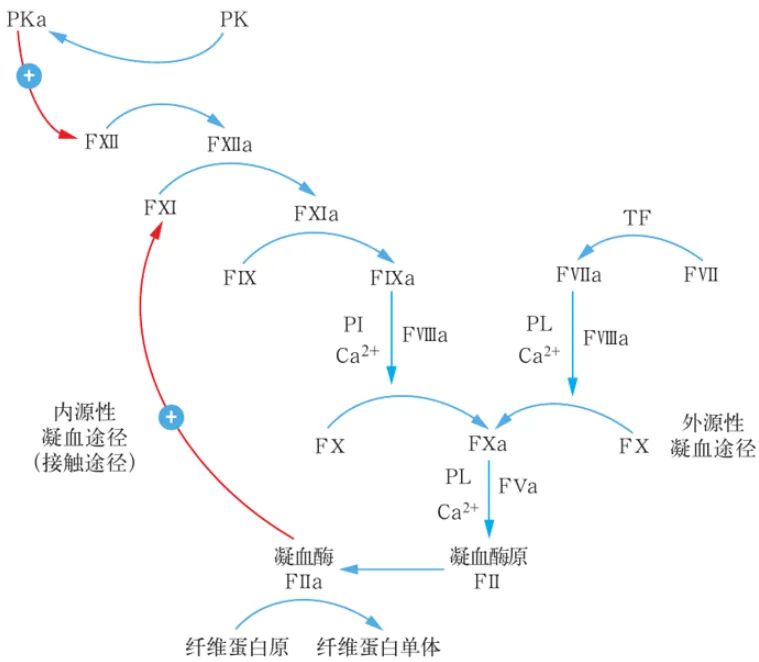
图4 内源性和外源性凝血途径
注:蓝色箭头表示催化方向,红色箭头表示正反馈促进;带负电荷的人工材料表面激活凝血因子Ⅻ(FⅫ)形成FⅫa,触发炎症和凝血的蛋白水解途径。FⅫa将血浆前激肽释放酶(PK)裂解为激肽释放酶(PKa),进而激活更多的FⅪ;然后,FⅨa在磷脂(PL)、Ca2+的催化下与FⅧa激活共同途径中的FⅩ。外源性凝血途径从组织因子(TF)开始,FⅦ激活后形成FⅦa,进而导致FⅩ的激活。通过这两种途径产生的FⅩa将凝血酶原裂解为凝血酶,最终将纤维蛋白原激活为纤维蛋白单体;凝血酶还能以前馈机制激活FⅪ。
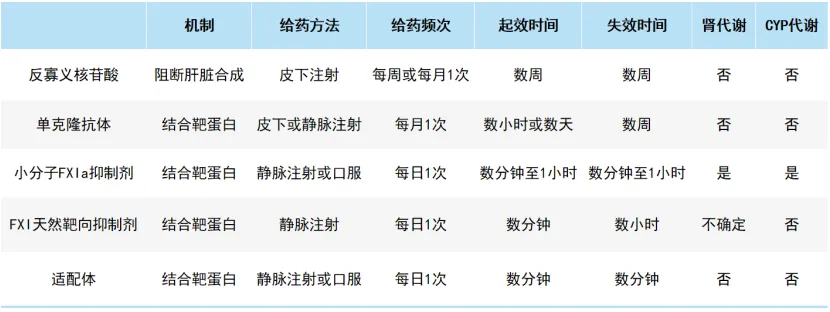
表2 不同类型FⅪ抑制剂的作用机制、使用方法及代谢方式


参考文献
作者介绍
中日医院呼吸与危重症医学科,硕士,主治医师,主要研究方向为呼吸衰竭与呼吸支持技术,重点着力于ECMO相关研究;参与危重患者救治,积累了丰富的呼吸机使用经验;作为主要参与人员承担国家自然科学基金项目1项;中国非公立医疗机构协会体外生命支持专业委员会委员。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信