登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:彭稳中

目前国内外指南共识对于抗凝目标没有统一推荐。在2021年体外生命支持组织(Extracorporeal Life Support Organization, ELSO)抗凝指南中,需要合理解释活化凝血时间(ACT)的值,而不是确定一个具体的值,可能更有助于临床;治疗后活化部分凝血活酶时间(APTT)达到患者治疗前的1.5~2.5倍;APTT 60~90 s,抗凝血因子Xa 0.3~0.7 IU/ml,肝素剂量可不变。2018年发布的《成人体外膜氧合循环辅助专家共识》中提到EOLIA研究中大多数患者APTT维持于40~55 s,ACT维持于180~220 s,抗凝血因子Xa维持于0.3~0.7 IU/ml。
文献提及的高目标抗凝是指APTT>60 s,ACT 140~180 s。也有学者认为ACT在180~220 s也可以是高目标抗凝,APTT 40~55 s为低目标抗凝。因此,目前关于高目标抗凝并没有确切的结论。

综上,在VV-ECMO患者中,血栓事件发生率高;因COVID-19需接受VV-ECMO支持者,血栓事件发生率更高;主要血栓事件包括管路、膜肺血栓,深静脉血栓及肺栓塞,缺血性脑卒中等;血栓事件的后果是膜肺及管路更换、患者死亡率增加。

血栓事件高发,抗凝不足,缘于:①初始抗凝不足;②发生出血事件后未能及时恢复抗凝。出血的危险因素众多,出血不一定与高目标抗凝及高剂量肝素相关!
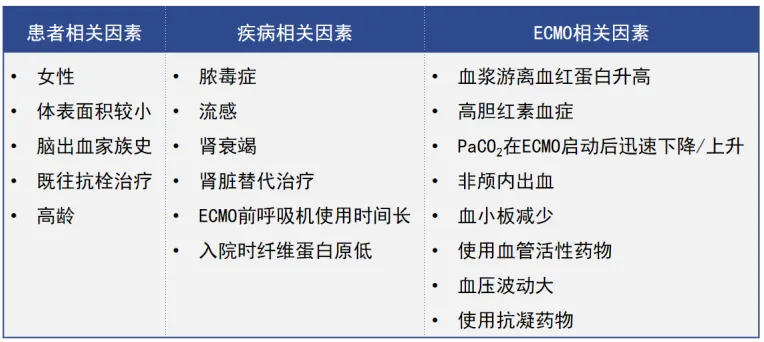
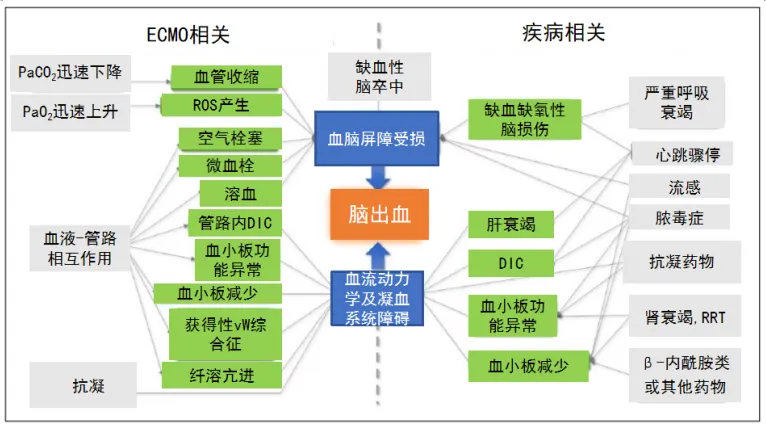
VV-ECMO患者颅内出血的危险因素涉及患者相关因素、疾病相关因素和ECMO相关因素(表1,图1)。在众多危险因素中,抗凝药物仅仅是其中一小部分,不能将其作为导致出血的唯一因素。

参考文献
作者介绍
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信