登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
作者:夏金根
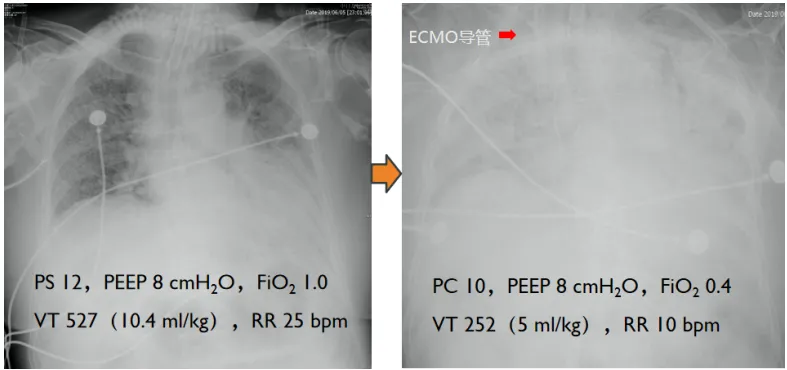
图1 ECMO前后患者胸片变化
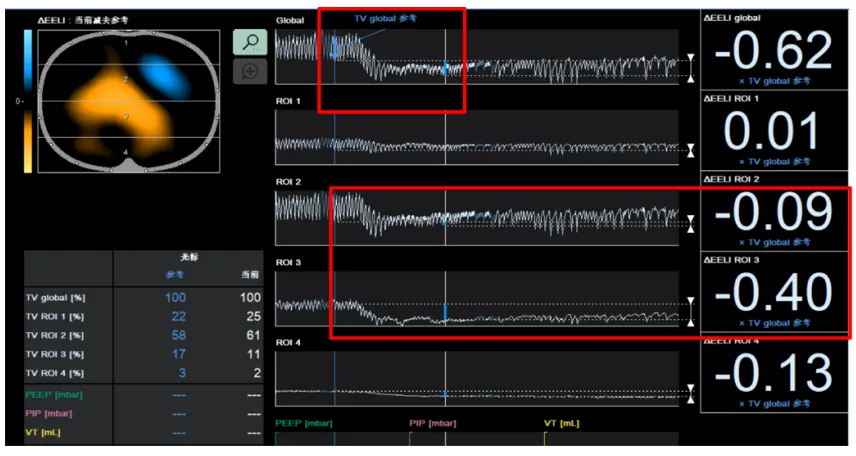
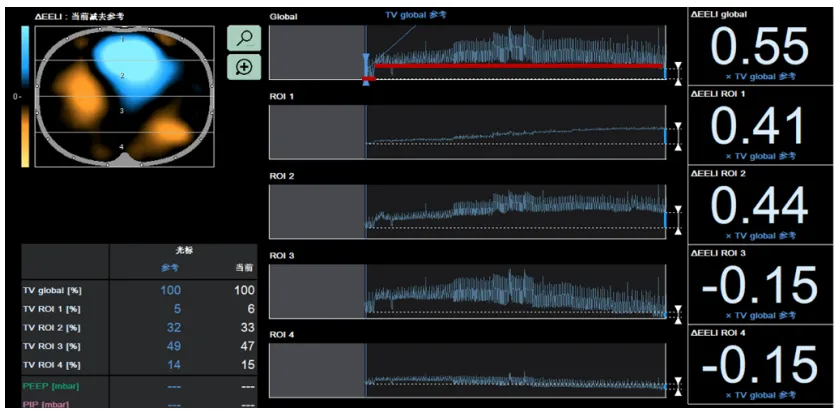
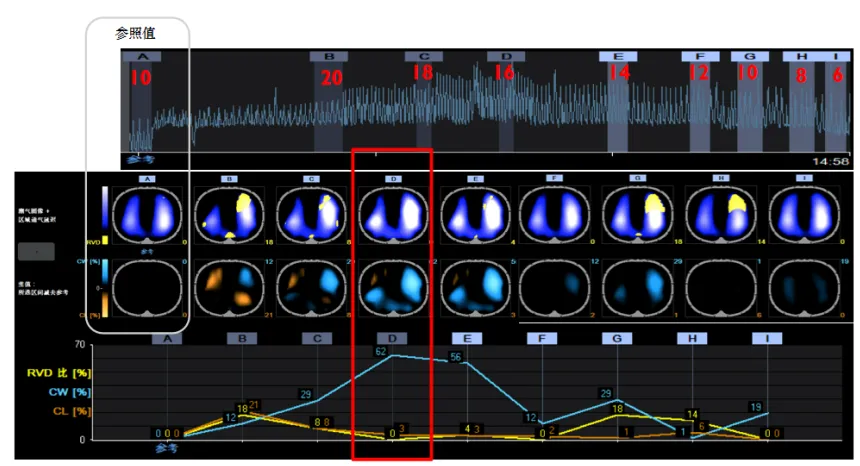
参考文献
作者介绍
中日医院呼吸与危重症医学科呼吸治疗师,中华医学会呼吸病学分会呼吸治疗学学组委员,中国医师协会呼吸医师分会呼吸相关职业发展工作委员会委员,中国医学装备协会呼吸病学装备专业委员会第一届委员,中国病理生理学会危重病专业委员会第一届呼吸治疗学组委员,中国康复医学会呼吸康复委员会委员,中国医学救援协会重症医学分会理事会理事。
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信